Projektleitung: Prof. Dr. Britta Qualmann in Kooperation mit Prof. Dr. Rainer Heintzmann (IPHT)
DFG (CRC/TR 166) 2015-2020
Projektleiterin: Prof. Dr. Britta Qualmann
DFG 2020-2020
Die Regulation der Anzahl und Organisation von Glycin-Rezeptoren in Synapsen ist für die Effizienz und Kontrolle der neuronalen Erregbarkeit im Rückenmark essentiell. Im Projekt werden daher die Dynamik und Organisation von Glycin-Rezeptor-Clustern sowie die spezifische Rolle von Syndapin I im Rezeptortransport und in Rezeptor-Clustering bzw. –Organisation [Koch et al., 2020] unter Anwendung superauflösender Lichtmikroskopie [Tröger et al., 2020] analysiert.
Projektleiterin: Prof. Dr. Britta Qualmann
DFG 2009-2021
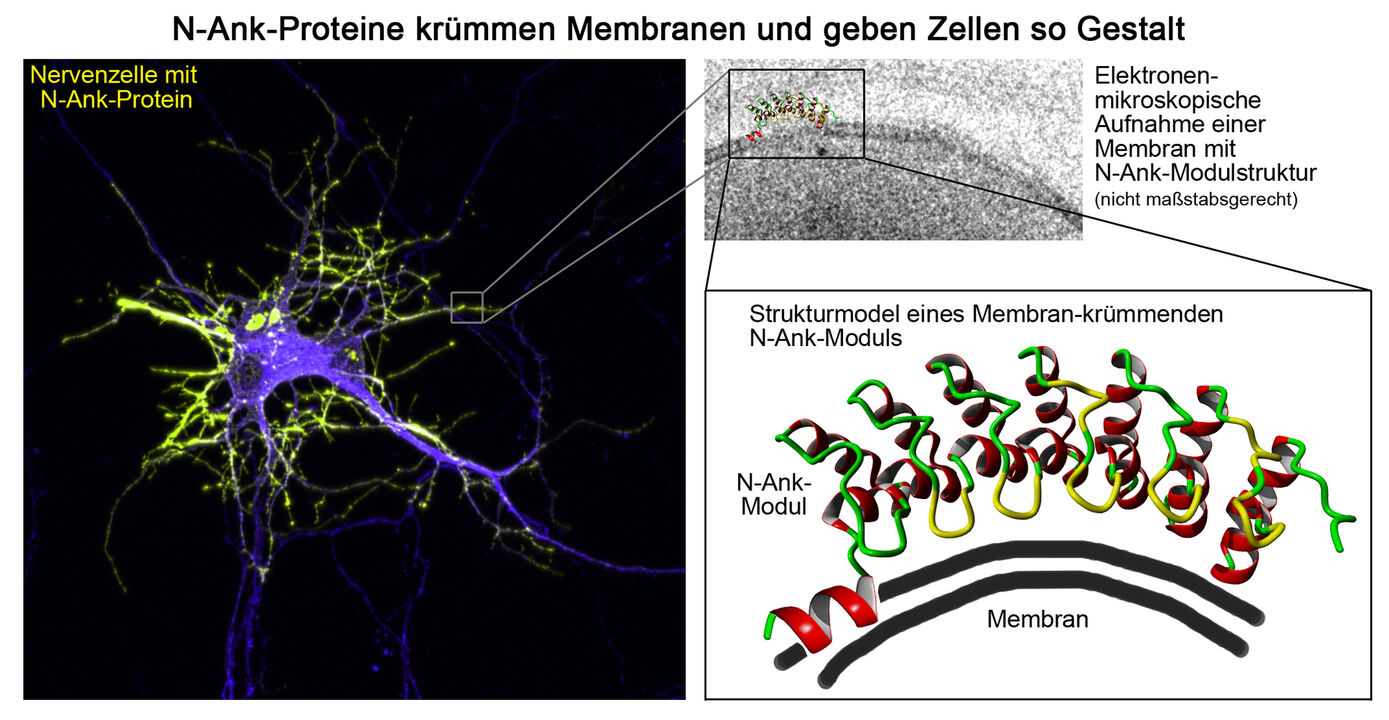
Syndapine vernetzen und koordinieren cytoskelettale und Vesikelbildungsmaschinerien [Koch et al., 2020]. Diese Funktionen basieren auf Syndapin-Selbstassoziation und der Bildung von multivalenten, Syndapin-Interaktionspartner vernetzenden Überstrukturen, die mit Membranen assoziieren und zu deren Krümmung führen. Weitere Untersuchungen in vivo zeigen, dass diese Funktionen für Membrantransportprozesse und Zellmorphologiekontrolle kritisch sind.
Projektleiterin: Prof. Dr. Britta Qualmann
DFG (GRK1715) 2012-2021
Ca2+-abhängige Komplexbildung des Aktinnukleators Cobl mit Calmodulin scheint einen wichtigen molekularen Mechanismus zur Verbindung von Signalprozessen mit Cytoskelett-vermittelten strukturellen und funktionellen adaptiven Reaktionen in Neuronen darzustellen. Unsere Studien sollen nun die exakten beteiligten Signalkaskaden und ihre zeitliche Koordination während adaptiver Stressantworten in der neuronalen Entwicklung, Differenzierung und Plastizität enthüllen.
Projektleitung: PD Dr. Michael Kessels
DFG (GRK1715) 2018-2021
Ein tieferes Verständnis der synaptischen Plastizität erfordert Kenntnisse darüber, wie die subzellulären Signale und die Effektoren, die postsynaptische Adaptionen ausführen, zeitlich und räumlich gesteuert werden. Unser Hauptziel ist eine zeitliche und räumliche Analyse der Signalwege in den Membranen postsynaptischer Spines, die auf unterschiedliche dosis- und zeitabhängige Stimulationsparadigmen des Neurotransmitters und des Stressors Glutamats reagieren.
Projektleitung: Prof. Dr. Britta Qualmann in Kooperation mit Prof. Dr. Felix Schacher (FSU Jena) und Prof. Dr. Michael Bauer (KAI)
DFG (SFB 1278) 2017-2021
In diesem Projekt werden multifunktionale Kern-Schale-Corona Mizellen mit kontrollierbarer Größe, Ladung und Ladungsdichte hergestellt, die im Nachgang für den Zell-spezifischen Transport von siRNA in Hepatozyten genutzt werden können. Dadurch soll eine effiziente und Zell-spezifische Belieferung mit Phosphoinositid-3-Kinase (PI3K-)γ Hemmern gelingen, was wiederum eine vielversprechende Strategie zur Prävention von Sepsis-bedingter hepatischer Dysfunktion darstellt.
Projektleitung: PD Dr. Michael Kessels
DFG 2011-2019
Die korrekte Ausbildung und Plastizität zellulärer Morphologie ist für alle Eukaryonten lebensnotwendig. Die erfolgreiche Erzeugung Cobl-defizienter Organismen erlaubt uns Einsichten in die Rolle dieses neuen Aktinnukleators für die Entwicklung, Differenzierung und Funktion von Zellen im intakten Organismus [Beer et al., 2020]. Diese Analysen zeigen eindrucksvoll, dass verschiedene Typen von ciliären Strukturen im Innenohr auf die Funktion des Aktinnukleators Cobl angewiesen sind.