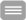Untersuchungen zur Funktion der Bindungsdomäne für zyklische Nukleotide für die Aktivierung von HCN-Kanälen
Ziel des vorgeschlagenen Projektes ist es, die Funktion des C-Linkers und der zyklischen Nukleotid-Bindungsdomäne in HCN (hyperpolarisationsaktiviert und durch zyklische Nukleotide moduliert)-Kanälen von Säugern und im homologen bakteriellen SthK-Kanal aus Spirochaeta thermophila zu untersuchen. Beide Kanaltypen bestehen aus vier Untereinheiten, wobei der C-Terminus jeder Untereinheit eine Bindungsdomäne für zyklische Nukleotide (CNBD) trägt, die über den C-Linker (CL) mit der letzten Transmembranhelix (S6) verbunden ist. Es wird die Patch-Clamp-Fluorometrie zur Anwendung kommen, eine Technik, die elektrophysiologische Methoden mit Fluoreszenzmikroskopie kombiniert. Zwei Variationen dieser Technik sind geplant:
- Beobachtung der Ligandenbindung in Abhängigkeit vom Aktivierungszustand mit Hilfe des fluoreszenz-markierten Liganden fcAMP
- Untersuchung zustandsabhängiger Konformationsänderungen des CLs und der CNBD zum einen durch die intrinsisch fluoreszierende unnatürliche Aminosäure Anap, zum anderen durch Förster-Resonanz-Energie-Transfer nach Markierung des Kanalproteins mit einem entsprechenden Donor und Akzeptor.
Die optischen und elektrophysiologischen Daten werden mit Hilfe von kinetischen Markov-Modellen und, in Kooperation mit H. Gohlke (P7), mit MD-Simulationen interpretiert. F. Noé und N. Plattner (P8) werden neue Strategien entwickeln, um Markov-Modelle an die Daten anzupassen.
Prof. Dr. Klaus Benndorf
Kollegiengasse 9
07743 Jena
Telefon: +49 3641 9397651
E-Mail:
Dr. Jana Kusch
Kollegiengasse 9
07743 Jena