Enthemmung und Hemmung der HCN2-Kanalfunktion durch Bindung von Liganden an die zyklische Nukleotid-Bindungsdomäne
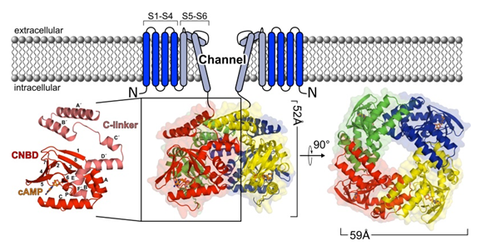
Hyperpolarisations-aktivierte (HCN) Kanäle sind relevante Krankheitsfaktoren, werden durch cAMP und cGMP aktiviert und bestehen aus vier Untereinheiten. Die Kanalfunktion wird durch die C-terminale Region moduliert, die eine Bindungsdomäne für zyklische Nukleotide (CNBD) und einen C-Linker (CL) enthält. Wir adressieren die zentrale Frage des Zusammenhangs von Änderungen in der Konformationsdynamik und Energetik der tetrameren CL-CNBD von HCN2 durch Bindung eines zyklischen Nukleotids und Ligand-abhängiger Kanalsteuerung. Wir beabsichtigen diese Frage auf atomistischer Ebene mittels Molekulardynamik-Simulationen, Berechnungen der freien Energie und Rigiditätsanalysen zu beantworten. Unsere Arbeiten stehen in engem Zusammenhang mit experimentellen Arbeiten in Projekt P2, die darauf abzielen, Konformationsänderungen der CL-CNBD während schrittweisem Binden eines zyklischen Nukleotids aufzuklären. Die Etablierung einer erfolgreichen Kombination aus adäquaten Rechenansätzen zur Modellbildung und Hypothesengenerierung sowie einer experimentellen Plattform für deren Validierung könnte im Hinblick auf die Untersuchung ähnlich komplexer Ionenkanäle paradigmatisch werden.