Kollegiatinnen & Kollegiaten
Übersicht der Projekte im Forschungskolleg AntiAge
Im Forschungskolleg werden zentrale Prozesse des Alterns (insbesondere Stammzellalterung, Immunoseneszenz, epigenetische Veränderungen und gestörte Autophagie) und deren Auswirkungen in verschiedenen Organsystemen modellhaft untersucht. Es sollen die Gemeinsamkeiten und Unterschiede im Alterungsprozess der Modellorgane herausgearbeitet werden mit dem Ziel organübergreifende Strategien für therapeutische Interventionen zu entwickeln.
Nachfolgend finden Sie die Themenfelder, die innerhalb des Else Kröner-Forschungskollegs bearbeitet werden:

Kollegiatinnen und Kollegiaten der ersten Förderperiode
Die Ausschreibung der Rotationsstellen innerhalb des Else Kröner-Forschungskollegs AntiAge erfolgte sowohl auf nationaler als auch auf internationaler Ebene in einschlägigen Fachjournalen. Die Kollegiatinnen und Kollegiaten der ersten Förderperiode konnten das Gutachtergremium in einem stark kompetitiven Verfahren mit ihren eingereichten Projektvorschlägen überzeugen.
Um den Kreis junger, forschungsaffiner Ärztinnen und Ärzte zu erweitern, sind dem Else Kröner-Forschungskolleg AntiAge die Kandidatinnen des Habilitationsprogramms der Medizinischen Fakultät "Förderung von Frauen in der Wissenschaft" (Pressemitteilung) assoziiert. Die assoziierten Kollegiatinnen führen ihre Forschung im Altersschwerpunkt durch und ergänzen damit hervorragend das Programm des Forschungskollegs.
Aktuelle geförderte Kollegiaten und Kollegiatinnen
Laura Bäz
Inhalt 1

Verbesserung von Diagnostik, Outcome-Prädiktion und Lebensqualität von Patienten vor und nach Transkatheter-Aortenklappen-Implantation (TAVI): Fokussierte Analyse des Jenaer Aortenklappenregisters (JAKR)
Das hier zu beschreibende Forschungsprojekt hat zum Ziel, das seit nunmehr 4 Jahren implementierte prospektiv gepflegte Jenaer Aortenklappenregister (JAKR) der Klinik für Innere Medizin I des Universitätsklinikums Jena einer strukturierten Analyse zu unterziehen. Dabei soll der Fokus auf einer Verbesserung der Diagnostik, Outcome-Prädiktion und Lebensqualität von Patienten mit hochgradiger degenerativer Aortenklappenstenose (AS) liegen. Hierbei soll insbesondere der Einfluss der
Transkatheter-Aortenklappen-Implantation (TAVI) als klar definierte strukturelle Intervention in einem Real World-Kollektiv von älteren Patienten mit moderatem bis hohem peri-operativem Risiko untersucht werden. Das anzuwendende Methodenspektrum umfasst, neben der Erhebung klinischer, laborchemischer, bildgebender und funktionsdiagnostischer Parameter, insbesondere die Analyse innovativer Biomarker kardiovaskulärer Gewebsumbauprozesse sowie die Untersuchung von allgemeinem Gesundheitsstatus, Lebensqualität, Angst und Depression. Ein Teilprojekt fokussiert auf eine neuartige psychoedukative Interventionsform (graphisch-erzählende medizinische Aufklärung additiv zur Standardaufklärung) zur Optimierung der Zufriedenheit mit der Aufklärung und potentiellen Reduktion des peri-interventionellen Angsterlebens durch ein verbessertes Verständnis des geplanten Eingriffs (TAVI).
Mihai Ceanga

Netzwerkdysfunktion in einem NMDAR-Antikörper Enzephalitis-Mausmodell: Implikationen für Pathophysiologie und Therapie
Die Enzephalitis mit Antikörpern (AK) gegen die NR1 Untereinheit des NMDA-Rezeptors (NMDAR) ist der Prototyp einer neuen Gruppe von autoimmunen Enzephalitiden. Das Krankheitsbild zeigt u.a. Aspekte einer akut verlaufenden Psychose zusammen mit neurologischen Symptomen wie Sprachstörungen, Bewegungsstörungen, epileptischen Anfällen und vegetativer Dysregulation. Die NMDAR-AK führen zu einer Reduktion der Zahl und Funktion der NMDAR, die genaue Pathomechanismen der neuropsychiatrischen Symptome sind aber weitestgehend unbekannt. In Vorarbeiten im Mausmodell fanden wir eine paradoxe synaptische Untererregbarkeit in CA1 Pyramidenzellen bei gleichzeitigem Nachweis von epileptischen Entladungen sowie eine Fehlregulation des Theta- und Gamma-Rhythmus in Hippocampus. In diesem Projekt sollen die molekularen Mechanismen der synaptischen Veränderungen aufgeklärt werden. Zudem sollen mithilfe von Netzwerkmodellierung elektrophysiologische Parameter auf drei Ebenen der Komplexität (zellulär, regionales Netzwerk und globales Netzwerk) in biologisch-plausible Netzwerkmodelle integriert werden, um neue mechanistische Erklärungsansätze zu finden und therapeutische Optionen aufzudecken. In einem direkt translationalen Projektteil sollen diese experimentellen Befunde sowie die in-silico Hypothesen zu EEG-Untersuchungen von Patienten mit NMDAR-Enzephalitis korreliert werden.
Isabel Graul
Verbesserung der Diagnostik, Behandlung, Therapie und Rehabilitation von Beckenringfrakturen - klinische und biomechanische Forschung
Die Beckenringfrakturen treten als Hochenergietraumata bei vorwiegend jüngeren Patienten oder als Folge von physiologischer Belastung im osteoporotischen Knochen als geriatrische lnsuffizienzfraktur auf. Ich möchte in dem geplanten Projekt die vulnerable Gruppe geriatrischer Patienten mit Beckenfrakturen bedingt durch mangelnde Knochenfestigkeit adressieren. Hierfür beleuchte ich multiple Aspekte der Diagnostik, Therapie und Rehabilitation von Beckenringfrakturen. In der
Diagnostik von Beckenringinsuffizienzfrakturen gibt es keinen Goldstandard, die DualSource-CT oder artifizielle Intelligenzen könnten hier entscheide Innovationen darstellen, um hoch sensitive, komfortable und kostengünstige Diagnostik betreiben zu können. Hinsichtlich der Frakturreposition sollen Einflussfaktoren auf die biomechanische Stabilität und Komplikationen der Eingriffe analysiert, sowie im biomechanischen Versuch die optimale Schraubenpositionierung gefunden werden. Das geplante Projekt leistet somit einen wichtigen Beitrag zur Verbesserung der altersgerechten Diagnostik und Behandlung von Beckenringfrakturen.
Irina Mäurer
Neurological adverse events in tumor patients receiving CAR-T-cells and immune checkpoint inhibitors: clinical and molecular patterns of toxicity effects (PARTICIPATE)
CAR-T-Zell-Therapien und Immuncheckpoint-Inhibition gewinnen als Behandlungsstrategien von onkologischen Erkrankungen über alle Altersgrenzen hinweg zunehmend an Bedeutung. Mit ihrem wachsenden Einsatz steigt die Inzidenz damit assoziierter neurologischer Phänomene. In Bezug auf die bildmorphologischen Charakteristika neurologischer Effekte, ihre Koinzidenz mit anderen Immuntherapie-Nebenwirkungen und den Einfluss von neurologischen Vorerkrankungen gibt es dennoch kaum Daten. Diese monozentrische Pilotstudie untersucht erstmals prospektiv den Stellenwert der systematischen Bildgebung mittels MRT, neuromuskulärer Sonographie und Raman-Spektroskopie bei der Identifikation neurologischer Immuntherapie-Effekte unter Berücksichtigung systemischer Nebenwirkungen und Vorerkrankungen. Hierzu werden 140 Tumorpatienten unter einer Behandlung mit CAR-T-Zellen oder Immuncheckpoint-Inhibitoren sowie 80 weitere Tumorpatienten, welche keine Immuntherapie erhalten, eingeschlossen. Primäres Ziel der Studie ist die Erfassung bildgebender Auffälligkeiten in MRT und neuromuskulärer Sonographie, um spezifische Läsionsmuster der ZNS- und PNS-Affektion zu identifizieren und damit die Diagnosestellung sowie das Monitoring Therapie-assoziierter Neurotoxizität zu vereinheitlichen. Eine Analyse mittels Raman-Spektroskopie dient zur Detektion eines biochemisch-morphologischen Immunzell-Profils der assoziierten (Neuro-)Toxizität.
Franziska Wagner

„Time is Brain“ Ein Konzept auch für die Rehabilitation?
Eine zerebrale Läsion bspw. im Rahmen eines ischämischen Schlaganfalles führt nicht nur zu einem lokalen Funktionsverlust der betroffenen Zellen, sondern darüber hinaus zu Beeinträchtigungen des gesamten zerebralen Informationsflusses. Diese läsionsbedingte akut verschlechterte Hirn-Netzwerk-Funktionalität führt zu komplexen Funktionsbeeinträchtigungen u.a. durch eine Reduktion der Lernfähigkeit. Voruntersuchungen in unserer Arbeitsgruppe deuten darauf hin, dass Fähigkeit zu Lernen wesentlich von der Funktionstüchtigkeit des zerebralen Belohnungs-Systems (Reward-Netzwerkes) abhängt. Dieses ist häufig in der Frühphase nach einem Schlaganfall gestört. Dennoch bietet die Frühphase nach einem Schlaganfall das größte Potential für eine langfristige Funktionserholung („sensible Phase“). Es ist aktuell unbekannt, ob sich eine solche „sensible Phase“ im chronischen Zustand reinitiieren lässt. Die Dauer der sensiblen Phase und der Zeitraum bis zur Funktionserholung des Reward-Systems können stark divergieren und sind interindividuell sehr verschieden. Erfolgreiches Rehabilitationstraining sollte innerhalb der sensiblen Phase, jedoch nach weitgehender Funktionserholung des Reward-Netzwerkes erfolgen. Dies entspricht nicht der Praxis. Ziel der vorliegenden Studie „Time is Brain, ein Konzept auch für die Rehabilitation“ ist, die Beziehung zwischen Rehabilitationspotential nach dem Schlaganfall, Zeit seit dem Schlaganfall und Funktionstüchtigkeit des Reward-Netzwerks zu erforschen. Ein zweites Ziel dieser Studie ist es, die Mechanismen der sensiblen Phase im Model außerhalb des
Schlaganfalls durch eine monokuläre Deprivation zu untersuchen. Die Umsetzung dieses Projektes verbindet behaviorale Untersuchungen, MEGKonnektivitätsanalysen, funktionelle MRT-Analysen und die Anwendung eines bed-side
Lerntests. Eine besonders effiziente Rehabilitationsphase soll in einem Pilotprojekt mittels monokulärer Deprivation innitiert werden.
Kollegiaten und Kollegiatinnen mit bereits abgeschlossenen Projekten
Annamaria Brioli
Die Rolle des Knochenmarkstroma bei der malignen Transformation multipler Myelom-Plasmazellen
Das Multiple Myelom (MM) ist nach Lymphomen die zweithäufigste maligne hämatologische Erkrankung und betrifft vor allem die ältere Bevölkerung. Das Durchschnittsalter bei der Diagnose beträgt 69 Jahre und mehr als ein Drittel der Patienten ist zum Zeitpunkt der Diagnose bereits älter als 75 Jahre. Durch den demographischen Wandel erhöht sich gleichzeitig das Durchschnittsalter der Bevölkerung, was eine Zunahme der MM-Inzidenz erwarten lässt.
Das MM weist spezifische Charakteristika auf, die es von anderen hämatologischen Krebs-erkrankungen unterscheiden. Die Entwicklung des MM folgt einem mehrstufigen Prozess: vom prämalignen Zustand der monoklonalen Gammopathie unbestimmter Signifikanz erfolgt die Entwicklung zum inaktiven Stadium des „schwelenden“ MM, anschließend zum aktiven Stadium des MM, bis zum Endstadium der Plasmazellen-Leukämie oder des extramedullären MM. Das Wachstum und Überleben der MM-Zellen ist dabei abhängig von den Wechselwirkungen mit dem umgebenden Mikromilieu, was ein weiteres wichtiges Merkmal darstellt. Obwohl die Bedeutung des Mikromilieus bei der Entwicklung des MM seit langem bekannt ist, sind die genauen Interaktionsmechanismen zwischen Mikromilieu und MM-Zellen noch nicht vollständig verstanden.
Wir vermuten, dass der Krankheitsverlauf durch das Mikromilieu und insbesondere durch molekulare Veränderungen in Knochenmark-Stromazellen (Bone Marrow Stromal Cells, BMSCs) beeinflusst wird.
Um unsere Hypothese zu überprüfen, werden BMSCs, die von MM-Patienten in verschiedenen Krankheitsphasen stammen, molekular auf etwaige Unterschiede hin untersucht, die für den Krankheitsverlauf verantwortlich sein können. Zudem werden von Patienten abgeleitete BMSCs mit MM-Zelllinien ko-kultiviert, was eine Beurteilung von deren Interaktion erlaubt.
Die Identifizierung von Unterschieden in BMSCs aus verschiedenen Krankheitsstadien sowie in MM-Zellen, welche mit diesen BMSCs ko-kultiviert wurden, wird einen tieferen Einblick in die Rolle des Knochenmark-Mikromilieus in der MM-Pathobiologie liefern. Die daraus resultierenden Ergebnisse könnten neue therapeutische Targets identifizieren, die das Fortschreiten der Krankheit, das durch das Mikromilieu gefördert wird, verzögern oder gar stoppen.
Philipp Ernst
Regulation der Seneszenz in hämatologischen Neoplasien
Philipp Felgendreff
Leberde- und rezellularisierung mit mesenchymalen Stammzellen (MSCs) in Abhängigkeit vom Alter der Leber und der MSCs
Der gesellschaftliche demographische Wandel führt zu einer deutlichen Zunahme von Patienten im hohen Lebensalter mit komplexen multifaktoriellen Problemfeldern. Bei diesem Patientenklientel existiert zwar einerseits ein erhöhtes perioperatives Risiko, andererseits profitieren sie jedoch auch deutlich von hochkomplexen operativen Eingriffen bis hin zu Organtransplantationen. Eines der bekanntesten Beispiele hierfür ist das EUROTRANSPLANT Senior Programm, welches den Überlebensvorteil von älteren organtransplantierten Patienten belegen konnte. Die Ausweitung der Organtransplantation auf dieses ältere Patientenklientel wird jedoch den weltweiten Mangel an Spenderorganen zusätzlich verschärfen.
Ein neuartiger Lösungsansatz, diesem Mangel entgegenzutreten, kann das Organengineering darstellen. Dabei werden in einem ersten Schritt alle Zellen aus einem explantierten Organ entfernt (Dezellularisation). In einem zweiten Schritt wird die zellfreie Matrix neu mit organtypischen oder Stammzellen besiedelt (Repopulierung). Sowohl die erfolgreiche Besiedlung der Matrix als auch der Nachweis einzelner organspezifischer Funktionen ist dabei vereinzelt belegt.
Ein der zentraler Forschungsschwerpunkt ist aktuell jedoch noch die Wahl des Zelltyps für den Repopulierungsprozess. Im experimentellen Setting kommen dabei immer häufiger Stammzellen von jungen Spendern für die Repopulierung zur Anwendung. In der klinischen Anwendung werden jedoch, bedingt durch den demographischen Wandel, vor allem ältere Stammzellspender für den Repopulierungsprozess zur Verfügung stehen. Der Einfluss des Alters auf die Besiedlung und den Nachweis organspezifischer Funktionen in der repopulierten Matrix ist dabei noch unklar.
Daher soll im Rahmen dieser experimentellen Arbeit der Einfluss des Alters des Stammzellenspenders auf den Erfolg des Organengineerings untersucht werden.
Von besonderem Interesse ist die Besiedlung der zellfreien Matrix mit Hilfe von Stammzellen. Dabei soll der Nachweis der organspezifischen Funktionen unter Beachtung des Alters des Stammzellspenders einer der wichtigsten Erfolgsparameter sein.
Alexander Jörk
Hämabbauprodukte und deren potentielle Bedeutung in der Entstehung zerebraler und retinaler Vasospasmen
Das verzögert auftretende sekundäre ischämische Defizit ist die bedeutendste Ursache für neurologische Ausfallerscheinungen bei Patienten mit initial überlebter Subarachnoidalblutung (SAB). Trotz des beachtlichen Fortschritts in der neurovaskulären Bildgebung zur Detektion des Auftretens zerebraler Vasospasmen, bleiben die präventiven und therapeutischen Möglichkeiten zur Behandlung dieser Komplikation limitiert und ohne Verbesserung der klinischen Prognose für betroffene Patienten, was auf die unzureichend verstandene Pathogenese der sekundären Perfusionsdefizite zurückzuführen ist. Vorangehende Studien zeigten, dass Hämabbauprodukte, die aus dem intrakraniellen Hämatom um rupturierte Gefäßaneurysmen stammen, in erhöhten Konzentrationen im Liquor von SAB-Patienten nachweisbar bleiben. Diese Abbauprodukte zeigten im Tiermodell eine Vasoaktivität im Sinne einer Vasokonstriktion von zerebralen Arteriolen. Arterielle Vasospasmen sind nicht nur auf das Gehirn beschränkt, sondern auch in retinalen Gefäßen von Patienten mit altersassoziierten Erkrankungen wie Makuladegeneration, Glaukom sowie diabetischer und hypertensiver Retinopathie nachweisbar.
Mithilfe von Zwei-Photonen Lasermikroskopie und der hochauflösenden funktionellen MR-Bildgebung bei einer Feldstärke von 9,4T soll der vasoaktive Effekt intrathekal applizierter Hämabbauprodukte auf Arteriolen und Kapillaren durch Messung funktioneller Parameter wie den zerebralen Blutfluss untersucht werden. Das Auge als diagnostisches Fenster zum Gehirn eröffnet darüber hinaus die Möglichkeit, die Wirkung intraokulär injizierter Hämabbauprodukte auf Mikrogefäße der Netzhaut der Maus mittels nicht-invasiver dynamischer Gefäßanalyse zu bestimmen.
Dieses Projekt verfolgt das Ziel, den Pathomechanismus und die potentiell auslösenden Faktoren zur Entstehung zerebraler und retinaler Vasospasmen weiter aufzuklären. Die hierbei gewonnenen Erkenntnisse können einen wichtigen Beitrag zur Entwicklung neuer Therapieoptionen zur Verhinderung Vasospasmus-bedingter ischämischer Defizite liefern.
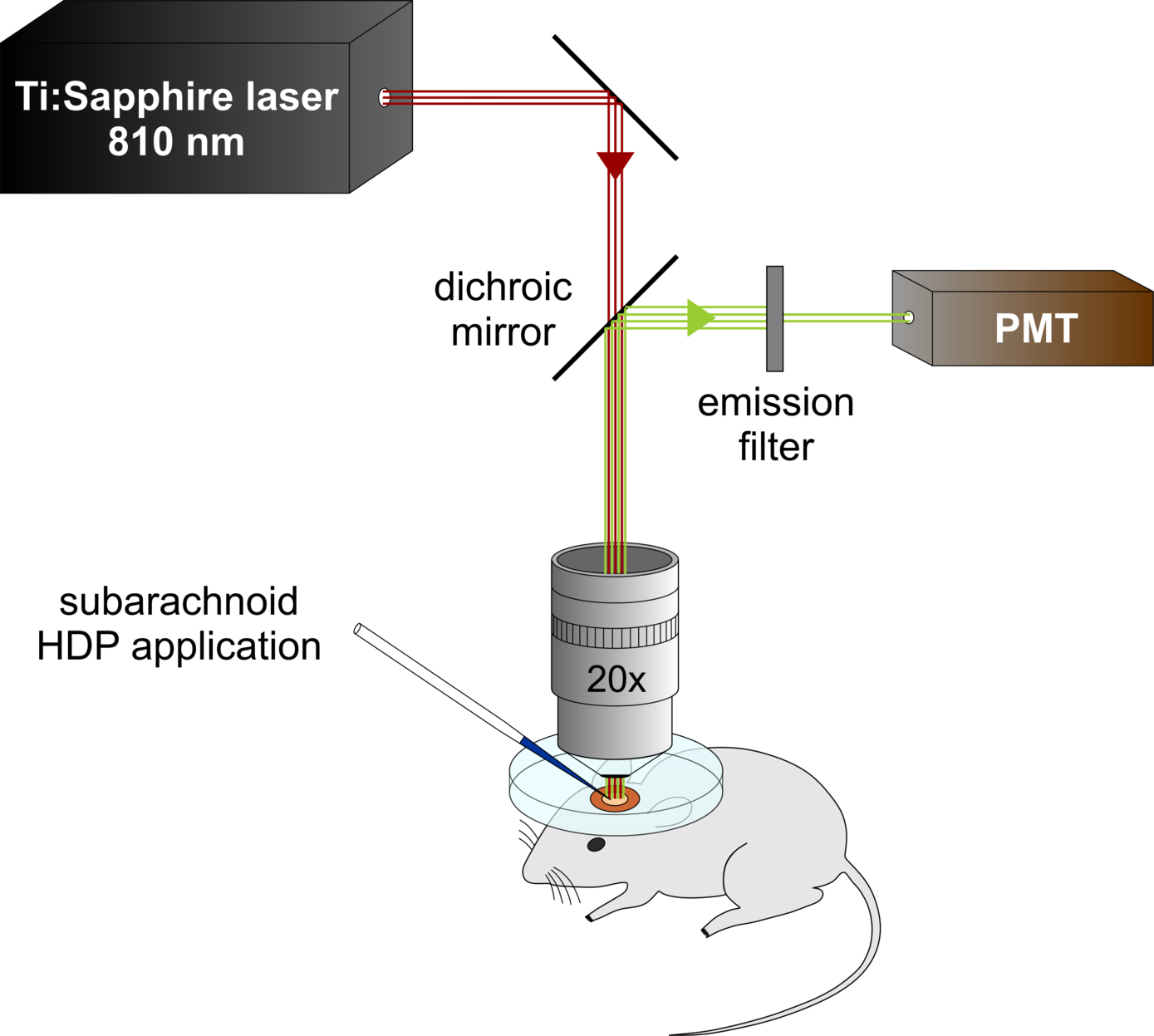
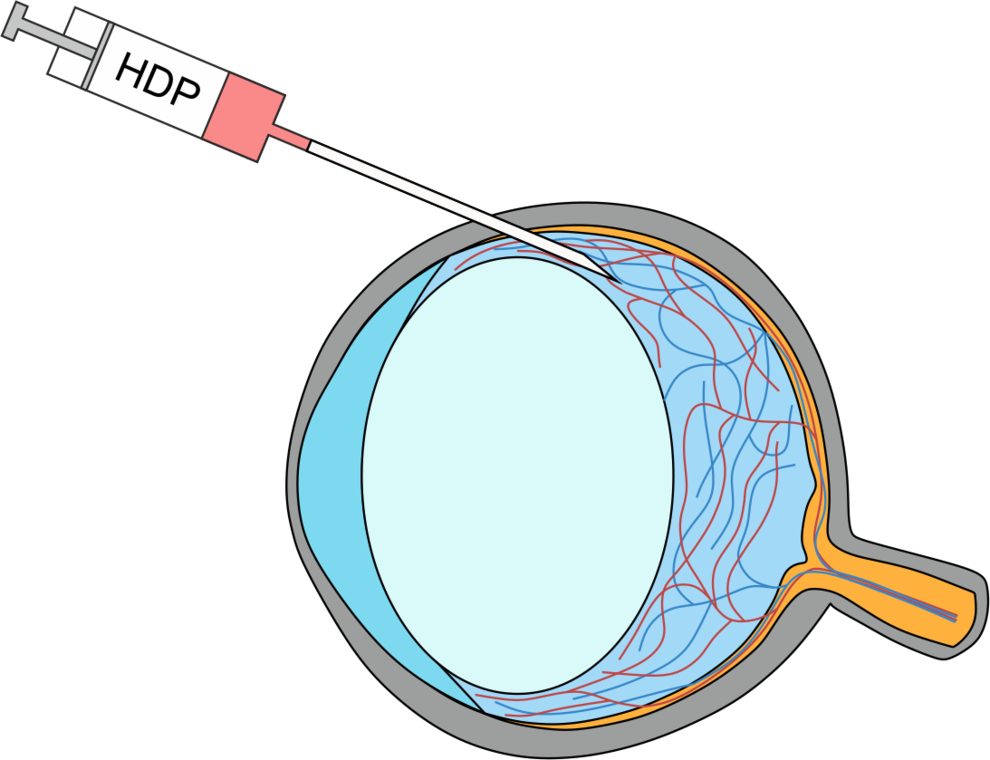
Sven Rupprecht
Zusammenhang von Insomnie und neurodegenerativen Erkrankungen
Zehn Prozent der erwachsenen deutschen Bevölkerung leiden unter behandlungsbedürftigen Ein- und Durchschlafstörungen. Der Schlaf erfüllt eine fundamentale Rolle in der homöostatischen Regulation höherer Hirnfunktionen. So finden während des Schlafes eine Drainierung des Gehirns von toxischen Metaboliten und Eiweißabbauprodukten statt. Des Weiteren findet während des Schlafes eine Reorganisation der Synapsen als Grundvorrausetzung der zerebralen Plastizität statt.
Im aktuellen Forschungsprojekt soll untersucht werden, inwieweit chronische Ein- und Durchschlafstörungen diese homöostatischen Prozesse stören und für neurokognitive und neurodegenerative Veränderungen prädisponieren. In einem multidisziplinären Ansatz wollen wir die neurokognitive Funktion (visuelle Aufmerksamkeitskapazität), synaptische Plastizität und Langzeitpotenzierung (transkranielle Magnetstimulation) und durch den Schlafmangel bedingte potenzielle strukturelle Veränderungen im Gehirn (biologisches Hirnalter, kortikale/sub-kortikale/hippocampale Atrophie, Eisenablagerung im MRT) bei Patienten mit einer chronischen primären Insomnie und gesunden Kontroll-Probanden untersuchen. Weiterhin wollen wir klären in welchem Ausmaß chronischer Schlafmangel die Kapazität des glymphatischen Systems zur Drainierung des Gehirns von Metaboliten und Peptiden vermindert (Diffusion Tensor Image Analyse des perivaskulären Raumes im MRT) und die Akkumulation von ß-Amyloid-Eiweiß im Gehirn (Flutemetamol F 18-labeled PET) und Liquor verstärkt.
Die neurokognitive Funktion von allen Patienten mit Insomnie soll in jährlichen „Follow Up“-Visiten nachkontrolliert werden. Ob eine Wiederherstellung der Schlafqualität durch kognitive Verhaltenstherapie oder pharmakologische Ansätze die negativen Effekte des chronischen Schlafmangels rückgängig machen kann, soll in nachfolgenden Untersuchungen geklärt werden.
Hans-Michael Tautenhahn
Autophagie-Mechanismen in der alternden, regenerierenden Leber
Ziel des Else Kröner-Forschungskollegs AntiAge ist die Untersuchung zentraler Prozesse des Alterns in verschiedenen Organsystemen. Hierin eingebettet soll mit dem Forschungsprojekt „Autophagie-mechanismen in der alternden, regenerierenden Leber“, ein wesentlicher wissenschaftlicher Beitrag geleistet werden.
Die Autophagie stellt einen zentralen Survivalmechanismus der Zelle dar. Vorarbeiten zeigen zudem, dass die Autophagie-Kapazität der Zelle mit steigendem Alter reduziert ist, was zu Beeinträchtigungen der Organfunktion und zu einer gestörten Stressantwort führen kann. Zur Darstellung der entscheidenden Bedeutung der Autophagie in Hinblick auf die Leberregeneration in Abhängigkeit vom Alter des Individuums, soll der Effekt einer Modulation der Autophagie in einem murinen Leberresektionsmodel aufgezeigt werden. Hierzu kann die Autophagie in der Leber bekanntermaßen sowohl durch mTOR (=mechanistic Target of Rapamycin) als auch durch PI3K (Phosphoinositid-3-Kinase) wesentlich gesteuert und koordiniert werden. Die beiden voneinander unabhängigen molekularen Kontrollwege können dabei gezielt pharmakologisch moduliert werden. Um unspezifische Einflussfaktoren im Alter möglichst auszuschließen, werden alle Versuche mit seneszenten und steatotischen Tieren sowie einer Kombination aus beiden durchgeführt.
Im Hauptversuch 1 soll das Regenerationsverhalten der steatotischen (NAFLD) und der seneszenten Leber charakterisiert werden. Im Hauptversuch 2 sollen die Effekte der Induktion und der Inhibition der Autophagie durch die Gabe von Lithium, Carbamazepin und Rapamycin bzw. Chloroquin, Wortmannin und SML0810 untersucht werden.
Hauptzielparameter, ist der Proliferationsindex am zweiten Tag nach der Leberresektion. Zu diesem Zeitpunkt erreicht dieser in Vorversuchen sein Maximum. Weitere Parameter der Regeneration sind der Ki-67, die Erholung des Leber-Gewichtes (liver weight to body weight ratio (LBWR)) und die Bestimmung der Regenerations-assoziierten Cytokine und Zellzyklus-assoziierten Zykline.
Im Sinne des translationalen Ansatzes soll die altersabhängige Störung der Autophagie und deren Einfluss auf das Regenerationspotential der Leber nach Leberresektionen, anhand von klinischen Proben verifiziert werden. Hierzu soll bei Patienten, die einer Leberresektion unterzogen werden eine Leberbiopsie und Serumproben entnommen und analysiert werden. Besonders interessant und aufschlussreich erscheinen hierbei Patienten, die im Rahmen Ihrer Tumorerkrankung zweizeitig operiert werden (ALPPS-Model).
Nadja Wystub
Autophagie-Insuffizienz als Mechanismus vaskulärer Alterung
Autophagie gehört zu den Mechanismen der molekularen und zellulären Qualitätskontrolle und ist für die Aufrechterhaltung der zellulären Homöostase verantwortlich. Vorläufige Daten zeigen, dass vaskuläre Endothelzellen für ihre Funktionsfähigkeit hohe basale Autophagie-Raten benötigen und dass diese in seneszenten humanen und in in-vivo gealterten Maus-Endothelzellen abnehmen.
Das vorgelegte Projekt hat das Ziel, die Funktion der Autophagie in Endothelzellen weiter zu charakterisieren und zu prüfen, ob ein kausaler Zusammenhang zwischen Abnahme der Autophagie und Zellalterung vorliegt. Dazu soll die Auswirkung einer pharmakologischen Autophagie-Hemmung beziehungsweise -Aktivierung auf Parameter der Seneszenz sowie auf endotheliale Funktionen bestimmt werden. Es soll weiterhin untersucht werden, welche Mechanismen zur Hemmung der Autophagie in alternden Zellen führen und ob dabei besonders die Autophagie von Zellorganellen (z.B. Mitophagie) betroffen ist. Besonderes Interesse gilt der Charakterisierung der lysosomalen Funktion im Rahmen der Autophagie sowie die Auswirkungen von lysosomalen Funktionsstörungen auf zelluläre Signalprozesse. Wir erwarten neue Erkenntnisse zu Targeting-Strategien, mit deren Hilfe über eine Verhinderung der altersbedingten Autophagie-Hemmung endotheliale Funktionen erhalten und kardiovaskuläre Erkrankungen vermindert werden können.
Silke Keiner
Leiterin der Arbeitsgruppe Neurale Stammzellen und adulte Neurogenese
Expansion of radial glia-like stem cells by modulation of intracellular chloride concentration in the hippocampal dentate gyrus during aging
Alexandra Kretz

AG Neurore- und degeneration
Neuroregeneration und -degeneration
Der fortschreitende Verlust funktioneller und struktureller Integrität, manifestiert in verschiedenen Zellpopulationen und Organen, stellt ein übergeordnetes Merkmal des Alterungsprozesses im humanen Organismus dar. Als involvierte Pathomechanismen werden u.a. Beeinträchtigungen in der DNA-Struktur und epigenetische Veränderungen, mitochondriale Dysfunktionen und metabolische Erschöpfung, ein gestörter interzellulärer Transport sowie eine defekte zelluläre Proteinhomöostase diskutiert. Eine damit einhergehende Verminderung von Reserve-, Reparatur- und Kompensationsfähigkeiten stellt einen wesentlichen Risikofaktor für altersbedingte Erkrankungen, wie z.B. kardiovaskuläre und neurodegenerative Pathologien dar.
Im Kontext von Chromatin- und subzellulären Proteinveränderungen untersuchen wir derzeit die Bedeutung einer aberranten, zytotoxischen Zellzyklus-Reinduktion im weitgehend postmitotischen ZNS-Milieu und deren Beitrag zu altersbedingter Dysfunktion und Zelltod. Eine entsprechende ‚replikative Reprogrammierung‘ maturer Neurone geht mit Veränderungen des zellulären DNA-Gehaltes einher und ist möglicherweise mit DNA-Instabilität assoziiert.
Entsprechend beschäftigen wir uns in einem zweiten Projekt mit der Frage, ob Neurone trotz ihres nominell post-replikativen Status einer altersassoziierten Dynamik in der Telomerlänge unterliegen.
Parallel zur aberranten Zellzyklus-Reitineration zeigten sich Zellzyklus-aktivierende Alterationen in der subzellulären Proteinkompartimentierung. Die essentielle biochemische Struktur, welche die subzelluläre Proteindistribution reguliert, ist der Kernporenkomplex. Daher werden wir in folgenden Studien analysieren, ob eine altersbedingte Degradierung von Effizienz und Selektivität des Kernporenkomplex-assoziierten Molekültransportes an der Fehlplatzierung von Zellzyklusproteinen beteiligt ist und zu Zellzyklus-assoziierter Dysfunktion und Zelltod beiträgt.
Zusammenfassend zielt unsere Forschung auf ein besseres Verständnis des physiologischen Alterungsprozesses ab und identifiziert Ansätze zur Förderung gesunden Alterns, unter Adressierung folgender ZNS-relevanter Inhalte:
- Aberrante Zellzyklus-Reinduktion im ZNS und deren Rolle für zelluläre und molekulare Neuroseneszenz
- Stabilität der Telomere im alternden ZNS jenseits Zellzyklus-bedingter Telomer-Verkürzungen
- Rolle des Kernporenkomplexes bei alters- und krankheitsbedingtem Verlust der Proteinhomöostase, zellulärer Dysfunktion und Neurodegeneration
Diana Morales
Stellv. Laborleiterin,
AG-Leiterin: Extrazelluläre Vesikel und miRNA
Effects of physiological and pathological trophoblast-derived extracellular vesicles on the blood-brain-barrier and microglia
Ulrike Schulze-Späte
Knochenstoffwechsel und Lipotoxizität bei Adipositas in Jugend und Alter
Meine klinisch-translationellen Forschungsprojekte sind im Bereich des Knochenmetabolismus und der lokalen Inflammation angesiedelt. Dazu gehören Projekte in der Basiswissenschaft mit einem engen Bezug zum zahnmedizinischen parodontologischen Fachgebiet, aber auch Projekte im Bereich der Patientenforschung.
In unseren Projekten untersuchen wir Mechanismen, die dem Knochenabbau bei systemischen Erkrankungen wie Adipositas zugrunde liegen. Wir analysieren grundlegende molekulare Signalwege, die die Homöostase der Knochen bei Adipositas regulieren, und definieren, wie diese als Reaktion auf eine parodontale bakterielle Infektion moduliert werden. Des Weiteren untersuchen wir, inwieweit Altern, ein komplexer multifaktorieller Prozess, der die Anfälligkeit für bakterielle Infektionen und nachfolgende chronische Entzündungserkrankungen erhöht, die lokale parodontale Reaktion im Knochen beeinflusst.
Eines der Hauptmerkmale der Adipositas ist eine erhöhte Konzentration von freien Fettsäuren im Gewebe und Serum. Bemerkenswert ist, dass Zellen offenbar unterschiedlich auf gesättigte und ungesättigte Fettsäuren reagieren. Es konnte bereits gezeigt werden, dass die Lipotoxizität durch die intrazelluläre Akkumulation von überschüssigen gesättigten Fettsäuren und deren Stoffwechselprodukten ausgelöst wird. Daher konzentrieren sich unsere Studien auf den Einfluss von Palmitinsäure (PA) und Ölsäure (OA), den am häufigsten in der westlichen Ernährung und im Serum vorkommenden gesättigten und einfach-ungesättigten Fettsäuren. Die zentrale Hypothese ist, dass eine übermäßige Akkumulation von gesättigter PA und seinen downstream liegenden, lipotoxischen, metabolischen Zwischenprodukten den Knochenstoffwechsel beeinflusst und darüber die Reaktion des Knochens auf eine bakterielle parodontale Infektion bei Adipositas moduliert.
Zusammenfassend lässt sich sagen, dass unsere Studien das Verständnis der wachsenden Adipositas-Epidemie vertiefen. Zudem werden neue therapeutische Strategien getestet, die zur Identifizierung von Targets für neue innovative therapeutische Interventionen führen können und letztendlich damit dem Knochenschwund entgegenwirken.
Geraldine Zimmer

Funktionelle Neuroepigenetik
Analyse der Dynamik des epigenetischen transkriptionellen Remodellings während der neuronalen Entwicklung und der altersbedingten Neurodegeneration
Die Modulierung der exzitatorische Reaktion von Pyramidenzellen durch die sehr unterschiedliche Gruppe von GABAergen Interneuronen ist entscheidend für die kortikale Informationsverarbeitung. Entwicklungsdefekte, die die Bildung solcher kortikalen Schaltkreise beeinträchtigen, wurden mit einer Vielzahl von neurologischen Störungen in Verbindung gebracht. Darüber hinaus trägt die selektive Anfälligkeit inhibitorischer Interneurone im Zuge von Alterungsprozessen zu kognitiven, sensorischen und motorischen Leistungen älterer Menschen bei.
Unsere Forschung konzentriert sich auf die Dynamik epigenetischer Transkriptionskontrolle während neuronaler Entwicklung, Funktion und altersbedingter Neurodegeneration der Großhirnrinde. Durch die Analyse interaktiver Netzwerke, die Schlüsselereignisse dieser Prozesse steuern, kann die Pathophysiologie assoziierter Erkrankungen besser verstanden werden. Unsere Arbeit basiert auf der systemischen und funktionellen Analyse von transgenen Mausmodellen und verschiedenen Zellkultursystemen. Für die zelluläre und subzelluläre Analyse wenden wir eine Reihe von bio-chemischen, molekularen und zellbiologischen Methoden an. Dazu gehören primäre neuronale Kulturen, funktionelle In-vitro-Assays, genetische Ex-vivo- und In-vivo-Manipulationen, Methylierungsstudien und Life Cell Imaging. Ein kürzlich etablierter methodischer Fokus stützt sich auf die globale Transkriptom-Analyse auf Einzelzell- und Gewebebasis.
Shoko Komatsuzaki
Kooperierendes Postdoc-Netzwerk "RegenerAging (SAW 2015)"
Im Leibniz-geförderten Postdoc-Netzwerk RegenerAging, beheimatet am Leibniz-Institut für Alternsforschung - Fritz-Lipmann-Institut e.V. (FLI), arbeiten die Postdocs an fachlich ineinandergreifenden Projekten. Dadurch soll das Verständnis für die funktionellen Beeinträchtigungen im Alter gefördert werden, die durch eine nachlassende Stammzellfunktionalität und Regenerationsfähigkeit entstehen. Zielsetzung der gemeinsamen Forschungsarbeit ist die Identifikation möglicher Therapieansätze und Präventionsstrategien für alternsassoziierte Dysfunktionen und Erkrankungen.
Durch die Kooperation beider Fördernetzwerke soll nicht nur eine intensive Zusammenarbeit, sondern vor allem ein reger Austausch unter den jungen Nachwuchswissenschaftlern gefördert werden. Gemeinsame wissenschaftliche Veranstaltungen, wie Seminare, Retreats oder Vorträge bilden dabei die Grundlage für Informationsaustausch, fachliche Diskussionen und methodische Ratschläge. Zusätzlich erhalten die Mitglieder beider Nachwuchsförderprogramme Zugang zu den Core-Facilities (Infrastruktur) der kooperierenden Institution.