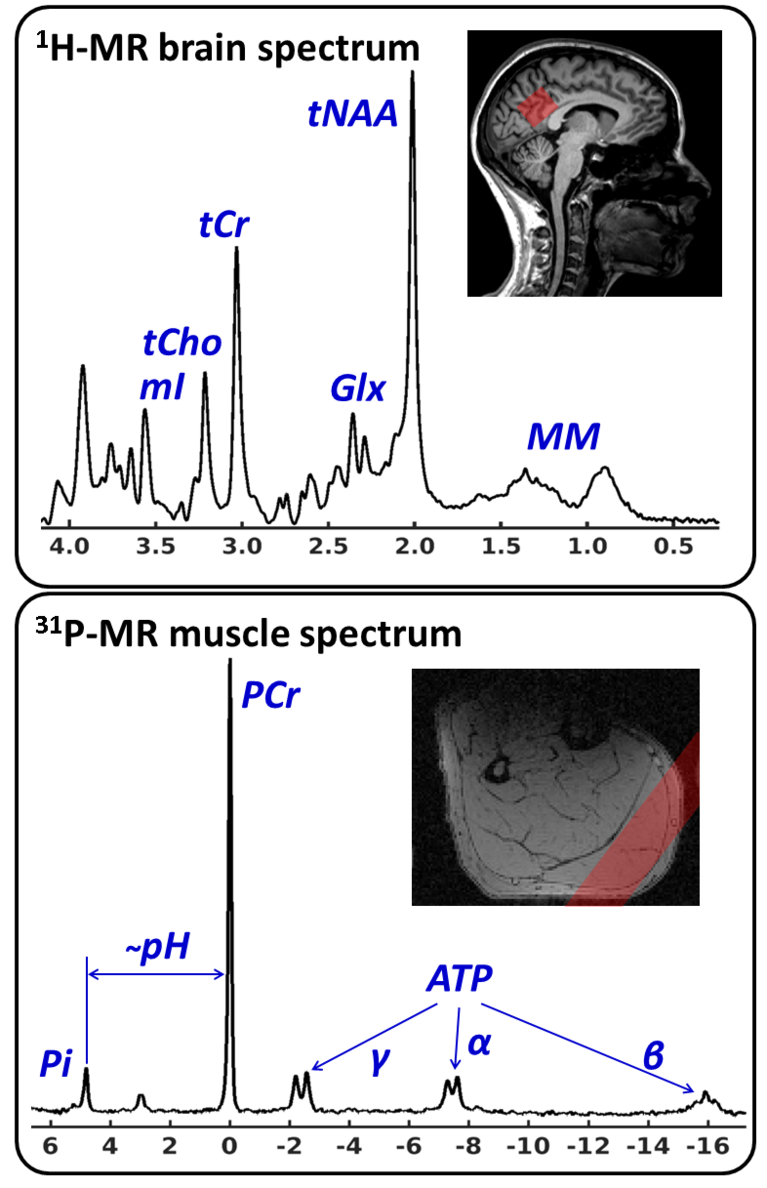
Die in vivo MR-Spektroskopie (MRS) ist derzeit eine der wenigen, an humanen MR Scannern etablierten Methoden zur Quantifizierung von Stoffwechselmarkern (Metaboliten) im lebenden Organismus. Die Relevanz für humane Anwendungen liegt hierbei in der Tatsache, dass MR spektroskopische Messungen lokalisiert, nichtinvasiv und ohne Einsatz ionisierender Strahlung durchgeführt werden. Somit können die extrahierten metabolischen Marker den mittels der MR Bildgebung gemessenen Gewebestruktur- oder Funktionsparametern gegenübergestellt werden um einen Einblick in biochemische Prozesse zu bekommen, welche zum Beispiel im Fall einer Erkrankung mit morphologischen Veränderungen einhergehen oder diese gar triggern. Neben gezielter Untersuchung von Einzelvolumina (z. B. in Krankheitsherden, Untersuchungsvolumen ≥1 ml) können auch die aus der MR Bildgebung bekannten Techniken der Ortskodierung angewandt werden um 2- oder 3-dimensionale Metabolitenkarten zu akquirieren (Chemical Shift Imaging, CSI). Eine verbreitete Anwendung in der Humanforschung sowie in der klinischen Diagnostik finden die Protonen- und die Phosphor-MR Spektroskopie (1H- und 31P-MRS), welche auf der Anregung und Messung der Resonanzsignale von Wasserstoff- und Phosphorkernen entsprechender Metaboliten basieren. Mittels der 1H-MRS können unter anderem Marker für die Dichte und Integrität verschiedener Zellarten (N-Acetyl-Aspartat und myo-Inositol im Gehirn) bzw. Zellmembranstoffwechselmarker (Cholin) gemessen werden, was insbesondere für das Monitoren neurodegenerativer bzw. onkologischer Erkrankungen wichtig ist (s. nebenstehende Abb., oben). Die 31P-MRS bietet wiederum die Möglichkeit wichtige Energiestoffwechselmarker wie ATP und Phosphorkreatin sowie den pH-Wert im Gewebe zu quantifizieren (s. nebenstehende Abb., unten). Im Allgemeinen beschäftigt sich die Arbeitsgruppe Medizinische Physik mit der Entwicklung und Implementierung neuer Methoden zur Akquisition, Artefaktunterdrückung, Nachverarbeitung und Quantifizierung von MR spektroskopischen Daten aus dem Gehirn und aus der Muskulatur.
MR Spektroskopie
Editierte 1H-MR Spektroskopie
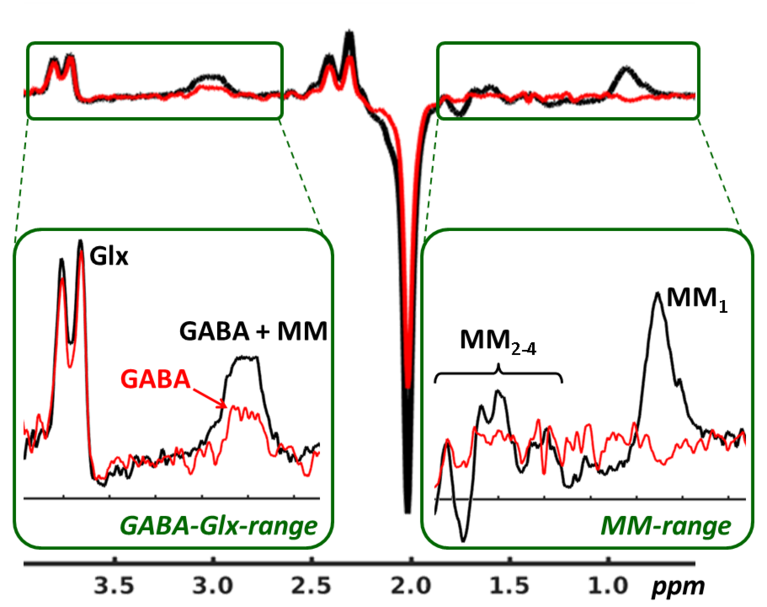
Bei der 1H-MRS liegt ein besonderes Augenmerk der AG Medizinische Physik auf sogenannten Editierungsmethoden zur Quantifizierung von Metaboliten, deren Signale im MR Spektrum aufgrund niedriger Konzentrationen sowie wegen einer vollständigen Überlagerung durch Resonanzen anderer Metaboliten in konventionellen MR Spektren (≥3 T) nicht detektierbar sind. Das gilt zum Beispiel für die wichtigsten Hirnneurotransmitter GABA und Glutamat, deren Konzentrationspattern eine zentrale Rolle bei der Hirnfunktionregulation spielen und somit für die Aufklärung von Funktionsstörungen bei psychiatrischen oder neurologischen Erkrankungen wichtig sind (s. Abb. links). Neben der Weiterentwicklung von Editierungssequenzen (Makromolekülunterdrückung, Lokalisation) sowie der Bereitstellung geeigneter Rekonstruktions- und Datenkorrekturalgorithmen (Phasen- und Frequenzkorrektur, Unterdrückung von Subtraktionsartefakten) wird diese Methode in zahlreichen klinischen und neurophysiologischen Studien angewandt. Als Beispiel hierfür wären die in unserer Gruppe implementierten funktionellen Messungen von schmerzreizevozierten GABA- und Glutamatänderungen zu nennen, welche zur Untersuchung neurometabolischer Anpassungen bei Akutschmerzverarbeitung herangezogen wurden. Aktuell finden Editierungsverfahren ihre Anwendung im Rahmen eines durch die Deutsche Forschungsgemeinschaft (DFG) unterstützten und im Verbund mit der Schmerztagesklinik des Universitätsklinikums Jena laufenden Forschungsprojekts:
„Beeinflusst eine multimodale Schmerztherapie den Neurotransmitterstoffwechsel und die funktio-nelle Konnektivität im Gehirn von Patienten mit chronischem Schmerz?“
Der Fokus dieses Projekts liegt auf der Dysfunktion des hemmenden und erregenden Neurotransmitterstoffwechsels sowie deren Auswirkung auf die funktionelle Konnektivität bei Patienten mit chronischen Rückenschmerzen. Neben Analyse initialer neurometabolischer Störungen bei chronischem Schmerz werden auch Veränderungen metabolischer und neurofunktionaler Parameter infolge einer multimodalen Schmerztherapie untersucht.
Funktionelle 31P-MR Spektroskopie im Muskel
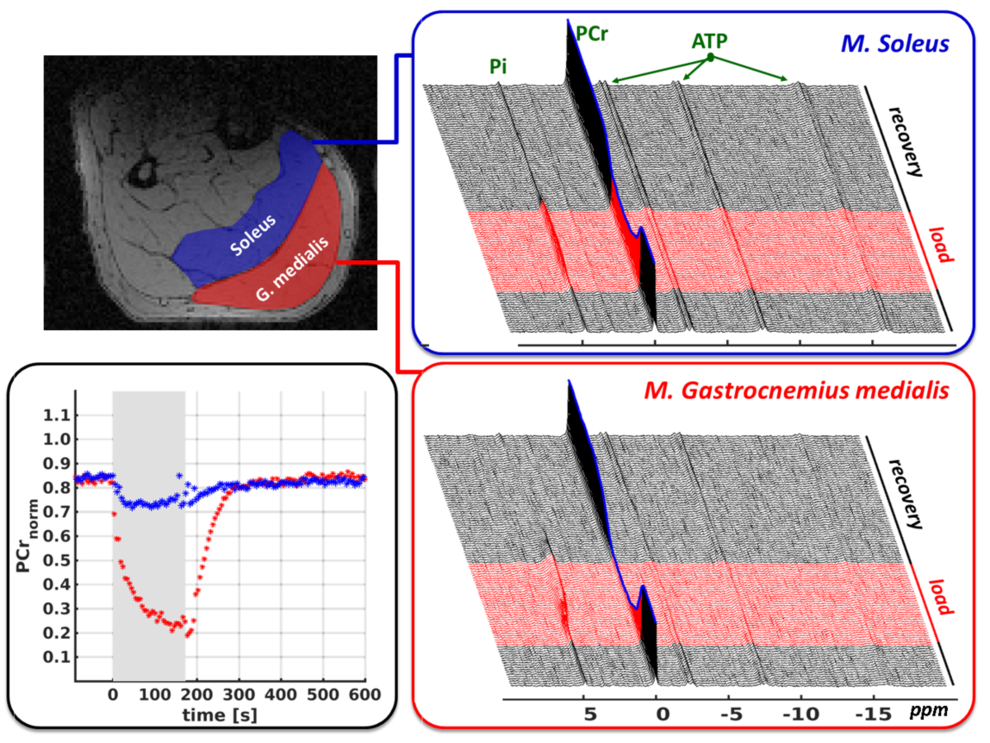
Weiterer Schwerpunkt der AG Medizinische Physik bilden die funktionellen Messungen von belastungsinduzierten Energiestoffwechseländerungen im menschlichen Muskel (dynamische Akquisition von 31P-MR Spektrenzeitserien während definierter Belastungen). Die hieraus bestimmten Phosphorkreatin und pH-Wertänderungen spiegeln belastungsstärkespezifischen ATP-Umsatz sowie Anpassungen im Protonengleichgewicht wieder und ermöglichen somit eine direkte Charakterisierung aerober und anaerober Energiebereitstellung. Dies letztendlich gibt Auskunft über metabolische Konditionierung des Muskels und die damit einhergehende Ermüdungsresistenz, welche bei zahlreichen physiologischen und klinischen Fragestellungen im Zusammenhang mit der Körperstabilität und -dynamik relevant ist. Für diese Art der Untersuchungen nutzen wir eine eigens entwickelte Messsequenz, welche lokalisierte, zeitlich hoch aufgelöste und semi-simultane Messungen von Spektrenzeitserien in mehreren Muskelgruppen ermöglicht (s. Abb. rechts).
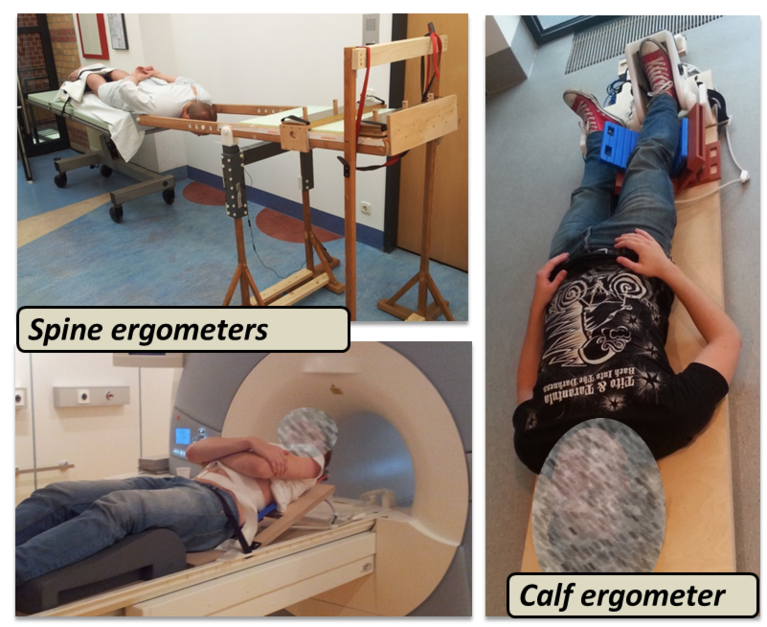
Neben Sequenzimplementierung gilt das Augenmerk eigener Arbeit auch der Entwicklung geeigneter MR-kompatibler Ergometer für möglichst realitätsnahe mechanische Belastungen unterschiedlicher Muskelgruppen im MR Scanner. Hierbei stehen der Arbeitsgruppe ein Pedalergometer für dynamische Belastungen der Wadenmuskulatur sowie mehrere Ergometer für statische Belastung der Rückenmuskulatur zur Verfügung (s. Abb., links). Alle Ergometer ermöglichen neben Einstellung definierter Belastungsstärken auch das Monitoren der Belastungsparameter. Ein weiterer Aspekt gegenwärtiger Forschung liegt in der Kombination funktioneller 31P-MRS mit etablierten Methoden zur Analyse des Energiestoffwechsels (Atemgasanalyse und Blutlaktatdiagnostik). Hierdurch sollen die Assoziationen zwischen lokalen energiemetabolischen Anpassungen im belasteten Muskel und den durch die Belastung evozierten globalen Veränderungen besser verstanden werden.
Kontakt
Publikationen
Fachzeitschriften (Methoden, 1H-MRS)
M Cleve, M Krämer, A Gussew, JR Reichenbach (2017). Difference optimization: Automatic correction of relative frequency and phase for mean non-edited and edited GABA (1)H MEGA-PRESS spectra. JMR (279), 16–21
M Cleve, A Gussew, G Wagner, K-J Bär, JR Reichenbach (2017). Assessment of intra- and inter-regional interrelations between GABA+, Glx and BOLD during pain perception in the human brain - A combined (1)H fMRS and fMRI study. Neuroscience (365), 125–136
M Cleve, A Gussew, JR Reichenbach (2015). In vivo detection of acute pain-induced changes of GABA+ and Glx in the human brain by using functional (1)H MEGA-PRESS MR spectroscopy. Neuroimage (105), 67–75
A Gussew, M Erdtel, P Hiepe, R Rzanny, JR Reichenbach (2012). Absolute quantitation of brain metabolites with respect to heterogeneous tissue compositions in (1)H-MR spectroscopic volumes. MAGMA (25), 321–333
A Gussew, R Rzanny, M Erdtel, HC Scholle, WA Kaiser, HJ Mentzel, JR Reichenbach (2010). Time-resolved functional 1H MR spectroscopic detection of glutamate concentration changes in the brain during acute heat pain stimulation. Neuroimage 49(2): 1895-902.
Fachzeitschriften (Methoden, 31P-MRS)
K Moll, A Gussew, M Nisser, S Derlien, M Krämer, JR Reichenbach (2018). Comparison of metabolic adaptations between endurance- and sprint-trained athletes after an exhaustive exercise in two different calf muscles using a multi-slice 31P-MR spectroscopic sequence. NMR Biomed. 31(4).
K Moll, A Gussew, C Hein, N Stutzig, JR Reichenbach (2017). Combined spiroergometry and (31) P-MRS of human calf muscle during high-intensity exercise. NMR Biomed, e3723
R Rzanny, N Stutzig, P Hiepe, A Gussew, H-A Thorhauer, JR Reichenbach (2016). The reproducibility of different metabolic markers for muscle fiber type distributions investigated by functional (31)P-MRS during dynamic exercise. Z Med Phys (26), 323–338
N Stutzig, R Rzanny, K Moll, A Gussew, JR Reichenbach, T Siebert (2016). The pH heterogeneity in human calf muscle during neuromuscular electrical stimulation. Magnetic Resonance in Medicine
P Hiepe, A Gussew, R Rzanny, C Anders, M Walther, H-C Scholle, JR Reichenbach (2014). Interrelations of muscle functional MRI, diffusion-weighted MRI and (31) P-MRS in exercised lower back muscles. NMR Biomed (27), 958–970
K Tschiesche, M Rothamel, R Rzanny, A Gussew, P Hiepe, JR Reichenbach (2014). MR-compatible pedal ergometer for reproducible exercising of the human calf muscle. Med Eng Phys (36), 933–937
Fachzeitschriften (Klinische und physiologische Studien)
S. Smesny, J Große, A Gussew, K Langbein, N Schönfeld, G Wagner, M Valente, JR Reichenbach (2018). Prefrontal glutamatergic emotion regulation is disturbed in cluster B and C personality disorders - A combined 1H/31P-MR spectroscopic study. J Affect Disord. 227: 688-697.
J Steinke, C Gaser, K Langbein, M Dietzek, A Gussew, JR Reichenbach, S Smesny, H Sauer, I Nenadić (2017). Hippocampal metabolism and prefrontal brain structure: A combined 1H-MR spectroscopy, neuropsychological, and voxel-based morphometry (VBM) study. Brain Res., 1677: 14-19.
L Janetzki, A Gussew, R Malessa, U Habenicht, JR Reichenbach, B Strauß, C Borys (2016). Cerebral metabolic changes and chronic back pain : Study taking into consideration clinical and psychological parameters. Schmerz (30), 134-140
G Wagner, A Gussew, S Köhler, F de la Cruz, S Smesny, JR Reichenbach, K-J Bär (2016). Resting state functional connectivity of the hippocampus along the anterior-posterior axis and its association with glutamatergic metabolism. Cortex (81), 104–117
I Nenadic, R Maitra, S Basu, M Dietzek, N Schönfeld, C Lorenz, A Gussew, GP Amminger, P McGorry, JR Reichenbach, H Sauer, C Gaser, S Smesny (2015). Associations of hippocampal metabolism and regional brain grey matter in neuroleptic-naïve ultra-high-risk subjects and first-episode schizophrenia. Eur Neuropsychopharmacol
S Smesny, A Gussew, NJ Biesel, S Schack, M Walther, R Rzanny, B Milleit, C Gaser, T Sobanski, CC Schultz, P Amminger, U-C Hipler, H Sauer, JR Reichenbach (2015). Glutamatergic dysfunction linked to energy and membrane lipid metabolism in frontal and anterior cingulate cortices of never treated first-episode schizophrenia patients. Schizophr Res
G Wagner, M Herbsleb, F Cruz, A Schumann, F Brünner, C Schachtzabel, A Gussew, C Puta, S Smesny, HW Gabriel, JR Reichenbach, K-J Bär (2015). Hippocampal structure, metabolism, and inflammatory response after a 6-week intense aerobic exercise in healthy young adults: a controlled trial. J Cereb Blood Flow Metab
I Nenadic, M Dietzek, N Schönfeld, C Lorenz, A Gussew, JR Reichenbach, H Sauer, C Gaser, S Smesny (2014). Brain structure in people at ultra-high risk of psychosis, patients with first-episode schizophrenia, and healthy controls: a VBM study. Schizophr Res (161), 169–176
I Nenadic, M Dietzek, K Langbein, R Rzanny, A Gussew, JR Reichenbach, H Sauer, S Smesny (2013). Effects of olanzapine on (31) P MRS metabolic markers in schizophrenia. Hum Psychopharmacol (28), 91–93
I Nenadic, M Dietzek, K Langbein, R Rzanny, A Gussew, JR Reichenbach, H Sauer, S Smesny (2013). Superior temporal metabolic changes related to auditory hallucinations: a (31)P-MR spectroscopy study in antipsychotic-free schizophrenia patients. Brain Struct Funct (219), 1869–1872
A Gussew, R Rzanny,D Güllmar, HC Scholle, JR Reichenbach (2011). 1H-MR spectroscopic detection of metabolic changes in pain processing brain regions in the presence of non-specific chronic low back pain. Neuroimage 54(2): 1315-23



