Generate-Boost
Information für Ärzte
Wie ist das Studiendesign?
Generate-Boost ist eine multizentrische, randomisierte, kontrollierte und doppelblinde Studie zur Überprüfung der Wirksamkeit und Sicherheit von Bortezomib bei Patienten mit schwerer autoimmuner Enzephalitis. Es sollen insgesamt 50 Patienten über einen Zeitraum von etwa zwei Jahren eingeschlossen werden. Die Randomisierung erfolgt 1:1 nach computerbasiertem Algorithmus, stratifiziert nach Prüfzentrum.
Bei insgesamt 20 Patienten mit schwerer autoimmuner Enzephalitis (mRS ≥ 3) soll der klinische Nutzen einer Gabe von Bortezomib (bis zu 3 Behandlungszyklen) zur Standard-Immuntherapie (Vorbehandlung mit Rituximab) im Vergleich zu 20 Patienten mit Gabe von Plazebo (0,9% NaCl-Lösung) untersucht werden.
Die Gabe von bis zu 3 Zyklen Prüfmedikation ist möglich. Ein Zyklus (21 Tage) besteht hierbei aus 4 subkutanen Injektionen an den Tagen 1, 4, 8 und 11 in einer Konzentration von je 1,3 mg/m2 Körperoberfläche (bei Verum Bortezomib). Obligat ist die zusätzliche Gabe von 20 mg Dexamethason in beiden Gruppen an diesen Tagen.
Weiterführende Information finden Sie auf den Seiten der DRKS
(https://www.drks.de/drks_web/navigate.do?navigationId=trial.HTML&TRIAL_ID=DRKS00017497)
und von Clinicaltrials.gov
(https://clinicaltrials.gov/ct2/show/NCT03993262?cond=Autoimmune+Encephalitis&cntry=DE&draw=2&rank=1 ).
Wer finanziert die Studie?
Die Studie wird im Rahmen des Verbundvorhabens CONNECT-GENERATE, eines nationalen Forschungsverbunds zur Erklärung, Kategorisierung und Behandlung autoimmuner Hirnentzündungen (Enzephalitiden) und verwandter Erkrankungen innerhalb des Deutschen Netzwerkes zur Erforschung autoimmuner Enzephalitiden durchgeführt. Gefördert wird das Projekt vom Bundesministerium für Bildung und Forschung (BMBF). Sponsor der Studie ist die Friedrich-Schiller-Universität Jena.
Wissenschaftlicher Hintergrund: Warum Bortezomib?
Therapeutisch sind Patienten mit autoimmuner Enzephalitis und Autoantikörpern gegen neuronale Oberflächenantigen mittels Immuntherapie behandelbar. Allerdings ist eine schnelle Immuntherapie nach Diagnosestellung erforderlich [6] und bislang besteht keine zugelassene und kontrolliert geprüfte Therapie für diese Erkrankungsgruppe. Nach Expertenkonsens werden verschiedene Kombinationstherapien angewendet, die auf die Reduktion der pathogenen Antikörper und Eindämmung des autoimmunen Prozesses ausgerichtet sind. In spezialisierten Zentren werden dazu Plasmaphereseverfahren und Kortisonpräparate (sog. „first-line“ Therapie) und B-Zell-Depletion mit Rituximab und/oder Cyclophosphamid (sog. „second-line“ Therapie) angewendet [7]. Trotzdem ist das Therapieansprechen oft verzögert, was für eine große Anzahl von Patienten einen langdauernden Klinikaufenthalt, oft über Wochen und Monate auch auf der Intensivstation mit teilweise auch ungünstigerem Verlauf bedeutet [8]. Das verzögerte und zum Teil ungenügende Ansprechen auf die derzeit durchgeführte Immuntherapie ist dadurch begründet, dass es keine spezifische Therapie gegen Plasmazellen gibt, die selektiv im Gehirn große Mengen an potentiell pathogenen Antikörpern produzieren [1, 9]. Die Plasmapherese- oder Immunadsorptionsverfahren können zwar systemische Autoantikörper aus dem Kreislauf entfernen, auf intrathekale Antikörper oder Antikörper im Parenchym des zentralen Nervensystems können diese Verfahren nur begrenzt einwirken. Die B-Zell-Depletion mit Rituximab reduziert zwar die Anzahl von B-Zellen und in der Folge auch von kurzlebigen Plasmazellen, aber die hauptsächlich Antikörper-produzierenden, langlebigen Plasmazellen (mit Oberflächenmarker CD138) bleiben davon unbehelligt [10, 11]. Bislang existieren keine Erkenntnisse kontrollierter, prospektiver Studien, die die Wirksamkeit von Immuntherapeutika bei diesem Krankheitsbild belegen.
Aufgrund dieser therapeutischen Lücke ist eine möglichst spezifische, auf die Autoantikörper produzierenden Plasmazellen abzielende Therapie nötig, um eine wirksame und schnelle therapeutische Option für die schwer und potentiell lebensbedrohlich betroffenen Patienten mit autoimmuner Enzephalitis und Antikörper gegen neuronale Oberflächenantigene zu erreichen.
In der vorliegenden multizentrischen, randomisierten, kontrollierten und doppelblinden Studie soll Wirksamkeit und Sicherheit von Bortezomib bei Patienten mit schwerer autoimmuner Enzephalitis geprüft werden.
Bortezomib ist ein Proteasom-Inhibitor, interferiert mit NF-κB und dem Ubiquitin-Proteasom Signalweg. Bortezomib wirkt deshalb bevorzugt auf Zellen mit hoher Proteinsynthese und führt in diesen Zellen zum Zelltod [11]. Plasmazellen haben eine sehr hohe Proteinsynthese und sind deshalb besonders anfällig für den Bortezomib-induzierten Zelltod. Deshalb ist Bortezomib bereits seit vielen Jahren Bestandteil der Chemotherapie bei Plasmozytom. Auch in systemischen Autoimmunerkrankungen, wie z.B. systemischen Lupus Erythematodes, gibt es erste Berichte, dass Bortezomib eine Depletion langlebiger Plasmazellen bewirkt und damit zu einer Reduktion pathogener Antikörper und klinischer Besserung führt [12]. In einer ersten Fallserie wurde das therapeutische Potential von Bortezomib bei 5 Patienten mit einer schwerwiegenden und therapierefraktären NMDAR-Enzephalitis beschrieben [10]. Hier führte die zusätzliche Therapie mit Bortezomib nach einem zum Teil sehr langen Krankheitsverlauf zu einer Verbesserung der Krankheitssymptome sowie zu einer Reduktion der Antikörper-Titer.
Das Nebenwirkungsspektrum von Bortezomib ist gut bekannt und ein kontinuierliches Sicherheitsmonitoring wird durchgeführt. Um den Patienten keine Standardtherapie vorzuenthalten, ist in den Einschlusskriterien die obligate Gabe von Rituximab enthalten. Bortezomib wird somit als Medikation bei bereits erfolgter first-line und second-line Therapie geprüft. Hierzu wird Bortezomib entsprechend dem in anderer Indikation zugelassenem Applikationszyklus verabreicht. Potentielle Nebenwirkungen umfassen v.a. eine Bortezomib-induzierte Polyneuropathie, die bei Absetzen der Medikation reversibel ist. Im Rahmen der klinischen Studie wird das Auftreten von Symptomen einer Polyneuropathie regelmäßig überprüft und das Studienmedikament wird in diesem Fall abgesetzt. In der bisherigen klinischen Erfahrung von Patienten mit autoimmuner Enzephalitis und Therapie mit Bortezomib war das Auftreten einer Polyneuropathie selten, von untergeordneter Bedeutung und vollständig reversibel nach Absetzen der Medikation[10]. Typische Nebenwirkungen von Bortezomib umfassen weiterhin Leberenzymerhöhungen, Thrombozytopenie sowie Anämie, was durch regelmäßige determinierte Blutuntersuchungen im Rahmen der Studie getestet wird. Diese und andere Laborauffälligkeiten (z.B. auch Elektrolytveränderungen) sind in der Regel voll reversibel. Vorübergehende Übelkeit, Erbrechen, Durchfall sind möglich und werden bei Auftreten klinisch überwacht. Dazu sind unter anderem mehrere Blut- und zwei Liquor-Untersuchungen vorgesehen. Diese können ggf. im Rahmen von Routine-Kontrollen mit abgenommen werden, wodurch keine zusätzliche invasive Belastung des Patienten notwendig ist.
Was sind die Ziele dieser klinischen Prüfung?
Ziel der Studie ist zu prüfen, ob eine Behandlung von Patienten mit Autoimmuner Enzephalitis mittels Bortezomib zu einer Verbesserung der Krankheitssymptome sowie zu einer Reduktion pathogener Antikörper-Titer führt.
Das primäre Ziel ist die modifizierte Rankin-Scale-Score (mRS) in Woche 17 nach der ersten Gabe der Prüfmedikation zu bestimmen.
Weitere Zielgrößen sind u.a. mRS- und GCS Scores 3, 6 und 9 Wochen nach erster Gabe der Prüfmedikation und im Follow-Up 13 Wochen nach der ersten Gabe der Prüfmedikation, Dauer des Krankenhausaufenthaltes / der Intensivstation, sowie Antikörpertiter/Destruktionsmarker/zelluläre Immunantwort und die neurokognitive Funktion jeweils zu Studienbeginn und im Follow-up 17 Wochen ersten Gabe der Prüfmedikation.
Die aufgetretenen schwerwiegenden unerwünschten Ereignisse innerhalb von 17 Wochen nach Randomisierung werden insbesondere hinsichtlich Bortezomib-Sicherheit in Bezug auf Polyneuropathie, Erhöhung der Leberenzyme und Sekundärinfektionen ausgewertet.
Ablauf
Die Studiendauer ist so veranschlagt, dass maximal 3 Zyklen Bortezomib verabreicht werden können (9 Wochen) und die Gesamtdauer der Studiendauer für jeden Patienten 17 Wochen beträgt. Die Studiendauer ist mit insgesamt 17 Wochen und 3 Zyklen Bortezomib ausreichend lange gewählt, dass eine klinische Besserung der schwer betroffenen Patienten erfasst werden sollte.
Auch wenn nur limitierte Vorerfahrungen mit Bortezomib bei Patienten mit autoimmuner Enzephalitis vorliegen [10] deuten diese darauf hin, dass eine klinische Besserung in etwa 8-12 Wochen nach Therapieeinleitung (erste Gabe Bortezomib) eintritt.
Ich behandle eine/-n Patienten/-in mit autoimmuner Enzephalitis. Kann ich sie/ihn an ein Prüfzentrum überweisen?
Ja, sehr gern können Sie sich hierzu mit Ihrem nächstgelegen Prüfzentrum in Verbindung setzen.
Kann ich mit meiner Klinik Prüfzentrum werden?
Kontaktieren Sie bitte zu dieser Frage den LKP, Prof. Dr. Christian Geis unter oder Telefon: +49-3641-9323413.
Wo erhalte ich weitere Informationen? An welchen Kliniken wird diese Studie durchgeführt?
Leiter der Klinischen Prüfung
Prof. Dr. Christian Geis
Universitätsklinikum Jena
Klinik für Neurologie
Am Klinikum 1
07747 Jena
Zentrum Jena
Ansprechpartner: Prof. Dr. Christian Geis
Zentrum Kiel
Ansprechpartner: PD Dr. Frank Leypoldt
Zentrum Ulm
Ansprechpartner: PD Dr. Jan Lewerenz
Zentrum Berlin
Ansprechpartner: PD Dr. Harald Prüß
Zentrum Münster
Ansprechpartner:PD Dr. Oilver Grauer
Zentrum Hannover
Ansprechpartner: PD Dr. Kurt-Wolfram Sühs
Zentrum München
Ansprechpartner: Prof. Dr. Tania Kümpfel
Zentrum Würzburg
Ansprechpartner: Prof. Dr. Claudia Sommer
Zentrum Bochum
Ansprechpartner: PD Dr. Ilja Ayzenberg
Zentrum Mainz
Ansprechpartner: Prof. Dr. Stefan Bittner
Zentrum Leipzig
Ansprechpartner: Prof. Dr. Florian Then Berg
Zentrum Göttingen
Ansprechpartner: Dr. med. Dirk Fitzner
Zentrum Aachen
Ansprechpartner:
Zentrum Frankfurt
Ansprechpartner: Prof. Dr. Felix Rosenow
Zentrum Düsseldorf
Ansprechpartner: PD Dr. Nico Melzer
Literatur:
- Dalmau, J., C. Geis, and F. Graus, Autoantibodies to Synaptic Receptors and Neuronal Cell Surface Proteins in Autoimmune Diseases of the Central Nervous System. Physiol Rev, 2017. 97(2): p. 839-887.
- Vitaliani, R., et al., Paraneoplastic encephalitis, psychiatric symptoms, and hypoventilation in ovarian teratoma. Ann Neurol, 2005. 58(4): p. 594-604.
- Hughes, E.G., et al., Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis. J Neurosci, 2010. 30(17): p. 5866-75.
- Haselmann, H., et al., Human Autoantibodies against the AMPA Receptor Subunit GluA2 Induce Receptor Reorganization and Memory Dysfunction. Neuron, 2018. 100(1): p. 91-105 e9.
- Petit-Pedrol, M., et al., LGI1 antibodies alter Kv1.1 and AMPA receptors changing synaptic excitability, plasticity and memory. Brain, 2018. 141(11): p. 3144-3159.
- Dalmau, J. and F. Graus, Antibody-Mediated Encephalitis. N Engl J Med, 2018. 378(9): p. 840-851.
- Graus, F., et al., A clinical approach to diagnosis of autoimmune encephalitis. Lancet Neurol, 2016. 15(4): p. 391-404.
- Schubert, J., et al., Management and prognostic markers in patients with autoimmune encephalitis requiring ICU treatment. Neurol Neuroimmunol Neuroinflamm, 2019. 6(1): p. e514.
- Martinez-Hernandez, E., et al., Analysis of complement and plasma cells in the brain of patients with anti-NMDAR encephalitis. Neurology, 2011. 77(6): p. 589-93.
- Scheibe, F., et al., Bortezomib for treatment of therapy-refractory anti-NMDA receptor encephalitis. Neurology, 2017. 88(4): p. 366-370.
- Neubert, K., et al., The proteasome inhibitor bortezomib depletes plasma cells and protects mice with lupus-like disease from nephritis. Nat Med, 2008. 14(7): p. 748-55.
- Alexander, T., et al., The proteasome inhibitior bortezomib depletes plasma cells and ameliorates clinical manifestations of refractory systemic lupus erythematosus. Ann Rheum Dis, 2015. 74(7): p. 1474-8.


Information für Patienten
Was ist Generate-Boost?
Generate-Boost ist eine Klinische Prüfung (Studie), zur Überprüfung der Wirksamkeit und Sicherheit von Bortezomib bei Patienten mit schwerer autoimmuner Enzephalitis. Diese Studie wird im Rahmen des Verbundvorhabens CONNECT-GENERATE, eines nationalen Forschungsverbunds zur Erklärung, Kategorisierung und Behandlung autoimmuner Hirnentzündungen (Enzephalitiden) und verwandter
Erkrankungen innerhalb des Deutschen Netzwerkes zur Erforschung autoimmuner Enzephalitiden durchgeführt und vom Bundesministerium für Bildung und Forschung finanziell gefördert.
Autoimmune Enzephalitis – was ist das?
Die autoimmune Enzephalitis ist eine Hirnentzündung, die durch körpereigene Stoffe, sogenannte Antikörper, ausgelöst wird. Antikörper sind normalerweise im gesunden Organismus an der Abwehr von Infektionen beteiligt. Bei Ihrer Erkrankung jedoch richten sich die Antikörper gegen Ihre körpereigenen Zellen (Autoantikörper) im Gehirn und stören sie in ihrer Funktion.
Warum wird diese Studie durchgeführt?
Für Patienten mit autoimmuner Enzephalitis gibt es noch kein spezifisch zugelassenes Medikament. Derzeit werden die Symptome mit bereits zugelassenen Medikamenten (Immuntherapie) behandelt, z.B. Kortison und Immuntherapien, die auch in der Onkologie eingesetzt werden. Diese Therapien sind unspezifisch und zielen darauf ab, die Autoantikörper zu reduzieren und den autoimmunen Prozess einzudämmen. Ein neuer Therapieansatz - zusätzlich zur Standardtherapie, die Sie bereits erhalten haben – soll in der hier vorgestellten Studie getestet werden: hierbei werden möglichst spezifisch diejenigen Körperzellen angegriffen, die die Autoantikörper produzieren. Bei diesem Therapieansatz wird das Medikament Bortezomib eingesetzt.
Bekomme ich das Studienmedikament in jedem Fall?
In dieser klinischen Prüfung wird Bortezomib mit einem Placebo (Scheinmedikament) verglichen. Bei einem Placebo handelt es sich um eine identisch aussehende Injektionslösung, die jedoch keinen Wirkstoff enthält. Im Falle Ihrer Teilnahme werden Sie entweder Bortezomib oder das Placebo erhalten. Der Vergleich mit dem Placebo dient dazu, die Wirkungen und Nebenwirkungen, also den Nutzen und die Sicherheit von Bortezomib besser beurteilen zu können.
Die Zuteilung zu einer der beiden Gruppen ist zufällig. Die Wahrscheinlichkeit, einer der bei-den Behandlungsgruppen zugeteilt zu werden, ist gleich groß (je 50 %).
Weder Sie noch das Studienpersonal wissen, ob Sie Bortezomib oder das Placebo bekommen (dieses Verfahren wird als „doppelblind“ oder „doppelt verblindet“ bezeichnet). Das Verfahren der Verblindung ist notwendig, um zu verhindern, dass Sie oder das Studienpersonal die Untersuchungsergebnisse beeinflussen.
Sollte es im Notfall aus Sicherheitsgründen notwendig sein, kann Ihr Prüfarzt aber sofort feststellen, welche Behandlung Sie erhalten.
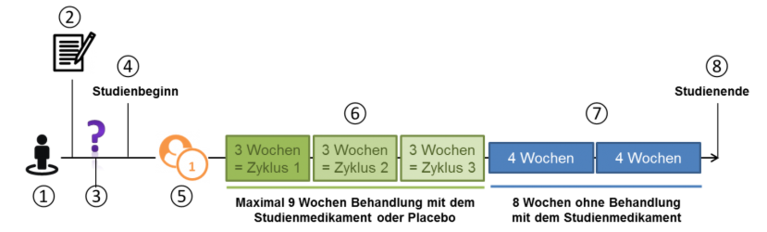
Wie ist der Studienablauf insgesamt?

- Sie leiden an autoimmuner Enzephalitis und überlegen, an der Studie Generate-Boost teilzunehmen?
- Ihr behandelnder Arzt wird mit Ihnen ein ausführliches Aufklärungsgespräch führen und Ihnen weitere schriftliche Informationen geben. Wenn Sie in die Studie einwilligen….
- …. prüft Ihr Studienarzt, ob Sie alle Voraussetzungen zur Studienteilnahme erfüllen
- Wenn das der Fall ist, können Sie an der Studie Generate-Boost teilnehmen
- Sie werden per Zufall einer von zwei Behandlungsgruppen zugeordnet: eine Gruppe erhält das Prüfmedikament Bortezomib (Experimentelle Gruppe), die Kontrollgruppe erhält ein Scheinmedikament (Placebo). Weder Sie noch Ihr Studienarzt werden wissen, in welcher Gruppe Sie sind.
- Die Studienbehandlung wird über mind. drei Wochen und maximal 9 Wochen gegeben. Das entspricht einem bzw. drei Behandlungszyklen. Wie viele Behandlungszyklen Sie erhalten, entscheidet Ihr Studienarzt.
- An die Behandlungsphase schließen sich mind. 8 Wochen ohne Behandlung an. Die Gesamtstudiendauer für Sie sind 17 Wochen.
- Nach 17 Wochen ist die Studie für Sie beendet.
Wie läuft ein Behandlungszyklus ab?

- Es gibt mindestens einen, maximal drei Behandlungszyklen
- Jeder Behandlungszyklus hat 21 Tage = 3 Wochen
- Während dieser drei Wochen wird Ihnen an 4 Tagen (Tag 1, Tag 4, Tag 8 und Tag 11) eine Injektion mit dem Studienmedikament unter die Haut verabreicht.
- Zusätzlich müssen Sie an diesen Tagen noch eine Tablette mit dem Wirkstoff Dexamethason einnehmen.
- An Tag 21 erfolgt eine Untersuchung und ggf. der Beginn eines weiteren Behandlungszyklus.
Wird mir Blut abgenommen? Muss ich sonst noch was beachten?
Ihnen wird zu mehreren Zeitpunkten Blut und Nervenwasser (Liquor) abgenommen, um die Anzahl der Autoantikörper in Ihrem Körper und weitere für die Behandlung wichtige Laborwerte zu bestimmen.
Außerdem werden wir Sie zweimal bitten, verschiedene Fragebögen zu beantworten.
Wo erhalte ich weitere Informationen? An welchen Kliniken wird diese Studie durchgeführt?
Leiter der Klinischen Prüfung
Prof. Dr. Christian Geis
Universitätsklinikum Jena
Klinik für Neurologie
Am Klinikum 1
07747 Jena
Zentrum Berlin
Ansprechpartner: PD Dr. Harald Prüß
Zentrum Bochum
Ansprechpartner: PD Dr. Ilya Ayzenberg
Zentrum Göttingen
Ansprechpartner: Dr. med. Dirk Fitzner
Zentrum Hannover
Ansprechpartner: PD Dr. Kurt-Wolfram Sühs
Zentrum Jena
Ansprechpartner: Prof. Dr. Christian Geis
Zentrum Kiel
Ansprechpartner: PD Dr. Frank Leypoldt
Zentrum Leipzig
Ansprechpartner: Prof. Dr. Florian Then Berg
Zentrum Mainz
Ansprechpartner: Prof. Dr. Stefan Bittner
Zentrum München
Ansprechpartner: Prof. Dr. Tania Kümpfel
Zentrum Münster
Ansprechpartner: PD Dr. Nico Melzer
Zentrum Ulm
Ansprechpartner: PD Dr. Jan Lewerenz
Zentrum Würzburg
Ansprechpartner: Prof. Dr. Claudia Sommer



