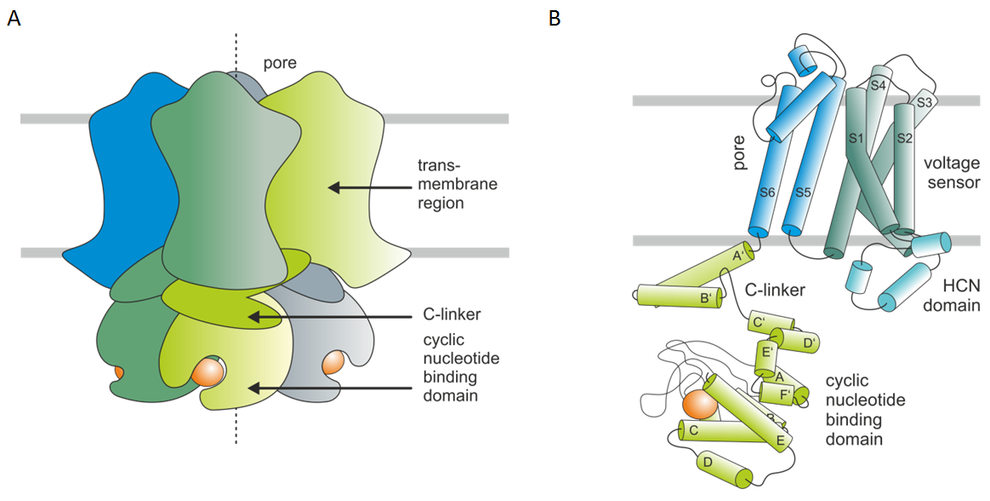
Im Rahmen dieses Projektes untersuchen wir die Funktion des C-linkers und der Bindungsstelle für zyklische Nukleotide (CN) in HCN- (hyperpolarization-activated and cyclic-nucleotide modulated) Kanälen von Säugern. Diese Kanäle bestehen aus vier Untereinheiten mit je einer CN-Bindungsstelle (CNBD) am C-terminus, die mit der letzten Transmembran-Domäne S6 über einen sogenannten C-linker (CL) verbunden ist.
Wir setzen die konfokale Patch-Clamp-Fluorometrie (cPCF) ein, eine Methode, die elektrophysiologische Techniken und konfokale Fluoreszenzmikroskopie miteinander kombiniert, um
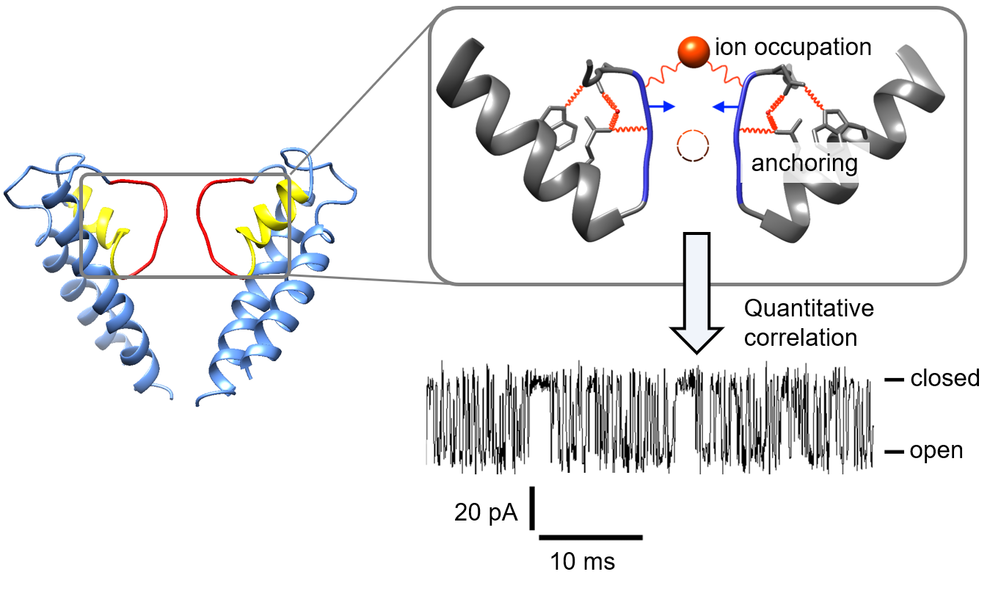
- die aktivierungs-abhängige Bindung des fluoreszierenden cAMP-Derivatives fcAMP zu untersuchen
- aktivierungs-abhängige Konformationsänderungen der CL-CNBD-Region mit Hilfe der intrinsisch fluoreszierenden unnatürlichen Aminosäuren Anap sowie mit Hilfe von durch Click-Chemie gekoppelten Farbstoffen zu studieren.
Die Daten werden in enger Zusammenarbeit mit Holger Gohlke (Universität Düsseldorf) und Frank Noé (Freie Universität Berlin) mit Hilfe von Markov-Modellen und MD-Simulationen kinetisch interpretiert.
Dr. Jana Kusch
Telefon: 03641 - 9 397668
Prof. Dr. Klaus Benndorf
Telefon: 03641 - 9 397651