Impact of Prenatal Stress on brain ageing
Fetal programming, undernutrition and stress
Our Mission
Slowing brain ageing and susceptibility to age-associated diseases:
Early programming of pathways and genes and late interventional targets.
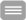
Die Klinik für Innere Medizin II ist spezialisiert auf die Behandlung von Blut- und Krebserkrankungen. Zahlreiche dieser Erkrankungen nehmen mit dem Alter zu. Doch auch ohne das Vorliegen von Bluterkrankungen lassen sich bereits Veränderungen der Blutbildung im Alter nachweisen. Die Untersuchungen von Alters-assoziierten Blut-Veränderungen und –Erkrankungen ist ein wissenschaftlicher Schwerpunkt unserer Abteilung.
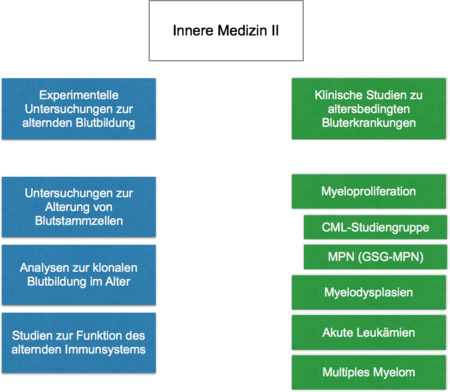
Adulte hämatopoetische Stammzellen (Blutstammzellen, HSC) sind in der Lage die Blutbildung des Menschen über viele Jahrzehnte des Lebens hinweg zu erhalten. Um die Blutbildung über viele Jahrzehnte erhalten zu können ist die Balance von Selbsterneuerungskapazität und Differenzierung zu reifen Blutzellen von grosser Wichtigkeit (Abbildung 1).
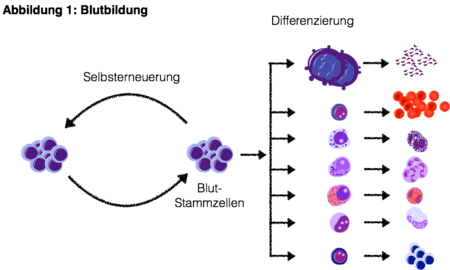
Aus kürzlich publizierten Genom-Analysen wissen wir, dass im Gesunden auch normale Blutstammzellen zahlreiche Genveränderungen (Mutationen) erwerben. Die Wahrscheinlichkeit solche Genveränderungen zu erwerben nehmen mit dem Alter signifikant zu. Eine Anhäufung von relevanten Mutationen in Blutstammzellen kann somit die Entstehung einer klonalen Hämatopoese bedingen und zu einer Störung der Balance zwischen Selbsterneuerung und Differenzierung führen. Die Verminderung der Ausreifung von Stamm- und Progenitorzellen resultiert dann in der Ausbildung von Zytopenien (Verminderung von reifen Blutzellen; Abbildung 2).
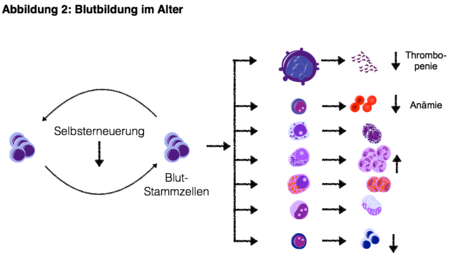
Durch das Auftreten von Genveränderungen in Blutstammzellen und eine übermässig gesteigerte Selbsterneuerungskapazität kann es zur Entstehung von bösartigen Bluterkrankungen kommen. Zahlreiche der beschriebenen Mutationen von Kinasen, Transkriptionsfaktoren und epigenetischen Regulatoren sind bereits als pathophysiologisch relevante Veränderungen bei Patienten mit myelodysplastischen Syndromen (ASXL1, EZH2) oder myeloproliferativen Neoplasien (JAK2, TET2) bekannt (Abbildung 3).
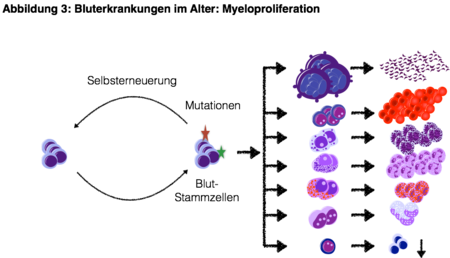
Durch den Einsatz moderner Technologien konnten in den vergangenen Jahren zahlreiche neue molekulare Aberrationen in Patienten mit MDS/MPN-Erkrankungen aufgedeckt werden, welche eine zunehmende Bedeutung zur Differenzialdiagnostik, Prognoseabschätzung, Resistenzaufklärung und Therapiewahl erlangen.
In der klinischen Versorgung unserer Patienten zählen die im Alter häufig auftretenden Myeloproliferativen Erkrankungen wie die Chronische Myeloische Leukämie (CML) und Philadelphia-Chromosom-negativen Myeloproliferativen Neoplasien, die Myelodysplastischen Syndrome und das Multiple Myelom zu unseren Schwerpunkten.
Die Anhäufung von Genveränderungen in Blutstammzellen kann zudem zur Entstehung von Leukämien beitragen. Der Zugewinn an übermässiger Selbsterneuerungskapazität durch genetische oder Epigenetische Veränderungen und der Verlust von Differenzierungs-Fähigkeit resultiert in der Vermehrung von unreifen Zellen und zum Versagen der normalen Blutbildung und des Immunsystems (Abbildung 4).
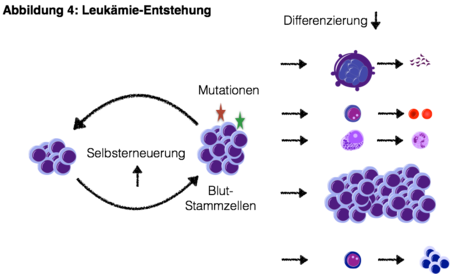
Das effektive Zurückdrängen der Leukämie (Remission), die Verhinderung von Rezidiven und die Elimination von resistenten Leukämie-Klonen stehen aktuell im Fokus präklinischer und klinischer Studien. Zahlreiche klinische Untersuchungen und Studien zur Behandlung von akuten Leukämien stehen aktuell zur Verfügung.
Ansprechpartner:
Klinik für Innere Medizin II:
Prof. Dr. A. Hochhaus (Direktor, Klinik für Innere Medizin II, Leiter der Deutschen CML-Allianz, Stellvertretender Sprecher des Zentrums für Alternsforschung Jena):
Prof. Dr. F. Heidel (Schwerpunkt Stammzell-Alterung, Leitgruppe der Deutschen MPN-Studiengruppe):
PD Dr. Th. Ernst (MDS, Klonale Hämatopoese):
Prof. Dr. M. v. Lilienfeld-Toal (Schwerpunkt Infektionen in der Hämatologie):
PD Dr. S. Scholl (Akute Leukämien):
CML-Allianz:
Studienzentrale:
Dr. Ch. Fabisch (Leiter der Studienzentrale): Christian.Fabisc
Zentrum für Altersforschung Jena:
Dr. Winfried Goettsch (Koordinator):

Meine klinisch-translationellen Forschungsprojekte sind im Bereich des Knochenmetabolismus und der lokalen Inflammation angesiedelt. Dazu gehören Projekte in der Basiswissenschaft mit einem engen Bezug zum zahnmedizinischen parodontologischen Fachgebiet, aber auch Projekte im Bereich der Patientenforschung.
In unseren Projekten untersuchen wir Mechanismen, die dem Knochenabbau bei systemischen Erkrankungen wie Adipositas zugrunde liegen. Wir analysieren grundlegende molekulare Signalwege, die die Homöostase der Knochen bei Adipositas regulieren, und definieren, wie diese als Reaktion auf eine parodontale bakterielle Infektion moduliert werden. Des Weiteren untersuchen wir, inwieweit Altern, ein komplexer multifaktorieller Prozess, der die Anfälligkeit für bakterielle Infektionen und nachfolgende chronische Entzündungserkrankungen erhöht, die lokale parodontale Reaktion im Knochen beeinflusst.
Eines der Hauptmerkmale der Adipositas ist eine erhöhte Konzentration von freien Fettsäuren im Gewebe und Serum. Bemerkenswert ist, dass Zellen offenbar unterschiedlich auf gesättigte und ungesättigte Fettsäuren reagieren. Es konnte bereits gezeigt werden, dass die Lipotoxizität durch die intrazelluläre Akkumulation von überschüssigen gesättigten Fettsäuren und deren Stoffwechselprodukten ausgelöst wird. Daher konzentrieren sich unsere Studien auf den Einfluss von Palmitinsäure (PA) und Ölsäure (OA), den am häufigsten in der westlichen Ernährung und im Serum vorkommenden gesättigten und einfach-ungesättigten Fettsäuren. Die zentrale Hypothese ist, dass eine übermäßige Akkumulation von gesättigter PA und seinen downstream liegenden, lipotoxischen, metabolischen Zwischenprodukten den Knochenstoffwechsel beeinflusst und darüber die Reaktion des Knochens auf eine bakterielle parodontale Infektion bei Adipositas moduliert.
Zusammenfassend lässt sich sagen, dass unsere Studien das Verständnis der wachsenden Adipositas-Epidemie vertiefen. Zudem werden neue therapeutische Strategien getestet, die zur Identifizierung von Targets für neue innovative therapeutische Interventionen führen können und letztendlich damit dem Knochenschwund entgegenwirken.

Die Arbeitsgruppe „Darm-Hirn Interaktion und Alterung“ untersucht Mechanismen, welche bei der Alterung des Gehirns eine Rolle spielen und erforscht inwieweit diese Prozesse – z.B. durch eine Änderung des Lebensstils: mehr Aktivität und Ernährungsumstellung - positiv zu beeinflussen sind. Da uns insbesondere die noch vorhandene Plastizität des alten Gehirns interessiert, werden die Maßnahmen zur Steigerung der Hirnplastizität bei alten Tieren vorgenommen bzw. der älteren Bevölkerung angeboten. Durch die Einbeziehung von tierexperimentellen Studien und Interventionsstudien am Menschen ist auch die Translation „bench to bedside“ im Fokus unserer Untersuchungen. Neueste Erkenntnisse zeigen einen Einfluss des Mikrobioms im Darm auf die Plastizität des Gehirns. Deshalb sind Analysen des Mikrobioms inzwischen Teil unserer Studien. Solche komplexen Studien, die auch eine exzellente bioinformatische Expertise benötigen, können nur in Kooperation durchgeführt werden. So arbeitet unsere Arbeitsgruppe intensiv mit der Christian-Albrechts-Universität zu Kiel (AG Prof. C. Kaleta) und dem Leibniz-Institut für Alternsforschung, Fritz-Lipmann Institut e.V. in Jena (AG Prof. S. Hoffmann) zusammen.
The "Ageing and Plasticity" research group investigates mechanisms that play a role in the ageing of the brain and examines the extent to which these processes can be positively influenced - for example, by a change in lifestyle: more activity and a change in diet. By including animal studies and intervention studies in humans, the translation "bench to bedside" is a focus of our research. Recent findings show an influence of the intestinal microbiome on the plasticity of the brain. Therefore, analyses of the microbiome are now part of our studies. Such complex studies, which also require excellent bioinformatics expertise, are carried out in intensive cooperation, especially with other research institutions in Germany and Europe.
Fotos: Marie-Luise Ederer und Madlen Günther
Nachfolgend finden Sie beispielhaft 3 aktuelle Projekte:
Else Kröner-Promotionskolleg „Jena School for Ageing Medicine (JSAM): Es ist allgemein anerkannt, dass körperliche Aktivität die kognitiven Fähigkeiten verbessert, auch wenn mit einem Training erst in einem späteren Alter begonnen wird. Allerdings sind die Auswirkungen eines „alternden“ Darms und des Mikrobioms auf die Plastizität des Gehirns, insbesondere in alten Organismen bisher kaum bekannt. In dem hier geplanten Projekt sollen Mäuse vom 22 bis zum 24 Lebensmonat einem nicht motorisierten freiwilligen Laufen in einem Laufrad ausgesetzt werden. Wir erwarten eine kognitive Verbesserung, Auswirkungen auf das Darmmikrobiom und die Metabolite, eine bessere Darmbarrierefunktion und eine verminderte Entzündungsreaktion sowohl im Hirn als auch im Kolon infolge der physischen Aktivität im Laufrad. Das hier zu beantragende Projekt ist Teil eines größeren Gesamtprojektes. Das Teilprojekt umfasst: die Mitbetreuung der Tierexperimente (Laufrad), Entnahme von Proben des Gehirns und des Dickdarms, RNA-Isolierung und qPCR zur Untersuchung von entzündlichen und immunologisch relevanten Prozessen. Während inflammaging (Entzündungsaltern) für das Gehirn gut untersucht ist, gibt es kaum Befunde für den Darm. Da jedoch ein veränderter Entzündungszustand des Dickdarms im Alter die Darm-Gehirn-Kommunikation negativ beeinflussen kann und somit einen Teufelskreis schaffen kann, der zu neurodegenerativen Erkrankungen führt, sind solche Untersuchungen von essentieller Bedeutung.
DFG EpiGutAge: Epigenom-Mikrobiom Crosstalk: Ein neuer Weg zur Erhaltung der Kognition im Alter: Kognitiver Verfall und Demenz gehören weltweit zu den wichtigsten alterungsbedingten Gesundheitsproblemen. Veränderungen im Lebensstil wie soziale Interaktion und körperliche Aktivität - auch wenn sie erst spät im Leben einsetzt - sind vorteilhaft für die Erhaltung der Kognition und ein gesundes Altern. Die Rolle des Darmmikrobioms bei der Modulation der Gehirnfunktion ist derzeit von hohem Interesse. Darmmikrobiota reagieren auf Umweltreize und erzeugen infolgedessen zahlreiche Metaboliten, die für die Physiologie des Wirts wichtig sind. Omics-Technologien (Sequenzierung des Transkriptoms, des Metagenoms und der 16S rRNA) werden angewandt, um Mäuse in verschiedenen Altersstufen und nach kognitionsmodulierenden Eingriffen zu analysieren. Ziel ist es ein in silico Modell der Mikrobiom-Darm-Hirn-Interaktion zu konstruieren. Aktuelle Publikationen zeigen, dass das Altern mit ausgeprägten Veränderungen der DNA-Methylierung verbunden ist und dass das Mikrobiom diesen epigenetischen Mechanismus stark beeinflusst. Daher beabsichtigen wir in diesem Projekt, unseren vorhandenen Datensatz mit Informationen über das Methylom in Dickdarm- und Hirnproben zu ergänzen. Eine Teilmenge von Hirnproben wird einer zelltypspezifischen Analyse unterzogen werden. Diese epigenomischen Daten werden unser in silico Stoffwechselmodell vervollständigen, um Interaktionen zwischen Mikrobiom und Gehirn im Laufe des Alterns, in Bezug zur kognitiven Funktion und ihre Beeinflussung durch kognitionserhaltende Eingriffe vorherzusagen und zu modellieren. Unser Modell soll in Zukunft als wesentliche Grundlage für das Design mikrobiombasierter Therapien dienen, mit dem Ziel kognitivem Funktionsverlust und Alterungspathologien entgegenzuwirken.
Unsere AG ist auch mit einem Teilprojekt in dem von Prof. O.W. Witte koordinierten Marie Skłodowska-Curie Innovative Training Network SmartAge (Beginn 09/2020) beteiligt. Gegenwärtig gibt es keine Möglichkeit das Fortschreiten von leichten kognitiven Beeinträchtigungen im Alter zur Entwicklung einer Demenz zu verhindern. Die vielversprechenden Fortschritte in der aktuellen Mikrobiomforschung bieten jedoch völlig neue Perspektiven für Diagnostik und Therapie. Gleichzeitig besteht ein großer Bedarf an Spezialisten auf diesem Gebiet. Ziel von SmartAge ist es, die Lebensqualität älterer Menschen zu verbessern und Kosten im Gesundheitssystem zu sparen, indem das Mikrobiom als Moderator zwischen Darm und Gehirn vor allem in seiner Wechselwirkung mit dem Alter und in seinen Auswirkungen auf die Kognition verstanden und genutzt wird. Ernährungs- und Lebensstil-Interventionen werden in einem translationalen Ansatz angewandt, um die kognitiven Funktionen im Alter zu steigern und die zugrundeliegenden Mikrobiom-assoziierten Mechanismen und spezifische Schlüsselregulatoren zu identifizieren. Das Netzwerk umfasst 16 europäische Forschungsinstitutionen, um 15 junge Forscher interdisziplinär auszubilden und somit die europäische Forschungslandschaft zu stärken.
Weiterführende Informationen unter: https://www.uniklinikum-jena.de/etnsmartage/en/.
Interventionen
Mauszucht
Molekularbiologie
Mikrobiota
Zellkultur
Verhaltenstest
Immunhistochemie/-floureszenz
Publications (Google Scholar, 03/2023): h-index: 26, i10-index 41, total citations: 2226
2023-2020
Restoring Age-Related Cognitive Decline through Environmental Enrichment: A Transcriptomic Approach.
Schmidt S, Haase M, Best L, Groth M, Lindner J, Witte OW, Kaleta C, Frahm C. (2022), Cells, 11(23):3864. doi: 10.3390/cells11233864.
Age-dependent increase of cytoskeletal components in sensory axons in human skin.
Metzner K, Darawsha O, Wang M, Gaur N, Cheng Y, Rödiger A, Frahm C, Witte OW, Perocchi F, Axer H, Grosskreutz J, Brill MS. (2022) Frontiers in Cell and Developmental Biology, 10: 965382. doi:10.3389/fcell.2022.965382
Voluntary Wheel Running in Old C57BL/6 Mice Reduces Age-Related Inflammation in the Colon but Not in the Brain.
Ederer ML, Günther M, Best L, Lindner J, Kaleta C, Witte OW, Simon R, Frahm C. (2022) Cells, 11(3). doi:10.3390/cells11030566
Poststroke dendritic arbor regrowth requires the actin nucleator Cobl.
Ji Y, Koch D, González Delgado J, Günther M, Witte OW, Kessels MM, Frahm C, Qualmann B. (2021) PLoS Biol 19(12):e3001399. doi: 10.1371/journal.pbio.3001399.
2021-2020
A limited role of NKCC1 in telencephalic glutamatergic neurons for developing hippocampal network dynamics and behavior.
Graf J, Zhang C, Marguet SL, Herrmann T, Flossmann T, Hinsch R, Rahmati V, Guenther M, Frahm C, Urbach A, Neves RM, Witte OW, Kiebel SJ, Isbrandt D, Hübner CA, Holthoff K, Kirmse K. (2021), Proc Natl Acad Sci U S A; 118(14):e2014784118. doi: 10.1073/pnas.2014784118
Microbiota profiling in aging-associated inflammation and liver degeneration.
Baumann A, Hernández-Arriaga A, Brandt A, Sánchez V, Nier A, Jung F, Kehm R, Höhn A, Grune T, Frahm C, Witte OW, Camarinha-Silva A, Bergheim I. (2021), International Journal of Medical Microbiology, 311(4):151500. doi: 10.1016/j.ijmm.2021.151500
Tissue-specific gene expression changes are associated with aging in mice.
Srivastava A, Barth E, Ermolaeva MA, Guenther M, Frahm C, Marz M, Witte OW (2020), Genomics Proteomics Bioinformatics, 18(4):430-442. doi: 10.1016/j.gpb.2020.12.001
2019-2015
Conserved aging-related signatures of senescence and inflammation in different tissues and species. Barth E, Srivastava A, Stojiljkovic M, Frahm C, Axer H, Witte OW, & Marz M. (2019), Aging, 11(19), 8556–8572. doi:10.18632/aging.102345
Changes in Oral Microbial Ecology of C57BL/6 Mice at Different Ages Associated with Sampling Methodology.Hernández-Arriaga A, Baumann A, Witte OW, Frahm C, Bergheim I, & Camarinha-Silva A. (2019), Microorganisms, 7(9), 283. doi:10.3390/microorganisms7090283
Mikrobiom und neurodegenerative Erkrankungen. Frahm, C., Witte, O.W. (2019), Der Gastroenterologe 14 (3), 166-171
Stroke Accelerates and Uncouples Intrinsic and Synaptic Excitability Maturation of Mouse Hippocampal DCX+ Adult-Born Granule Cells. Ceanga M, Keiner S, Grünewald B, Haselmann H, Frahm C, Couillard-Després S, Witte OW, Redecker C, Geis C, & Kunze A. (2019), The Journal of neuroscience : the official journal of the Society for Neuroscience, 39(9), 1755–1766. doi:10.1523/JNEUROSCI.3303-17.2018
Mechanistic basis of an epistatic interaction reducing age at onset in hereditary spastic paraplegia. Newton T, Allison R, Edgar JR, Lumb JH, Rodger CE, Manna PT, Rizo T, Kohl Z, Nygren A, Arning L, Schüle R, Depienne C, Goldberg L, Frahm C, Stevanin G, Durr A, Schöls L, Winner B, Beetz C, & Reid E. (2018), Brain : a journal of neurology, 141(5), 1286–1299. https://doi.org/10.1093/brain/awy034
Transcriptomic alterations during ageing reflect the shift from cancer to degenerative diseases in the elderly. Aramillo Irizar P, Schäuble S, Esser D, Groth M, Frahm C, Priebe S, Baumgart M, Hartmann N, Marthandan S, Menzel U, Müller J, Schmidt S, Ast V, Caliebe A, König R, Krawczak M, Ristow M, Schuster S, Cellerino A, Diekmann S, Englert C, Hemmerich P, Sühnel J, Guthke R, Witte OW, Platzer M, Ruppin E, Kaleta C. (2018), Nature communications, 9(1), 327. https://doi.org/10.1038/s41467-017-02395-2
Sigma 1 receptor activation modifies intracellular calcium exchange in the G93AhSOD1 ALS model. Tadić V, Malci A, Goldhammer N, Stubendorff B, Sengupta S, Prell T, Keiner S, Liu J, Guenther M, Frahm C, Witte OW, & Grosskreutz J. (2017), Neuroscience, 359, 105–118. https://doi.org/10.1016/j.neuroscience.2017.07.012
Transcriptional profiling reveals protective mechanisms in brains of long-lived mice. Frahm C, Srivastava A, Schmidt S, Mueller J, Groth M, Guenther M, Ji Y, Priebe S, Platzer M, & Witte OW. (2017), Neurobiology of aging, 52, 23–31., https://doi.,org/10.,1016
Phosphoinositide 3-Kinase γ Restrains Neurotoxic Effects of Microglia After Focal Brain Ischemia. Schmidt C, Frahm C, Schneble N, Müller J, P, Brodhun M, Franco I, Witte OW, Hirsch E, Wetzker R, & Bauer R. (2016), Molecular neurobiology, 53(8), 5468–5479. https://doi.org/10.1007/s12035-015-9472-z
Reduced tonic inhibition after stroke promotes motor performance and epileptic seizures. Jaenisch N, Liebmann L, Guenther M, Hübner CA, Frahm C, & Witte OW. (2016), Scientific reports, 6, 26173. https://doi.org/10.1038/srep26173
The spectrum of KIAA0196 variants, and characterization of a murine knockout: implications for the mutational mechanism in hereditary spastic paraplegia type SPG8. Jahic A, Khundadze M, Jaenisch N, Schüle R, Klimpe S, Klebe S, Frahm C, Kassubek J, Stevanin G, Schöls L, Brice A, Hübner CA, & Beetz C. (2015), Orphanet journal of rare diseases, 10, 147. https://doi.org/10.1186/s13023-015-0359-x
Branched-chain amino acid catabolism is a conserved regulator of physiological ageing. Mansfeld J, Urban N, Priebe S, Groth M, Frahm C, Hartmann N, Gebauer J, Ravichandran M, Dommaschk A, Schmeisser S, Kuhlow D, Monajembashi S, Bremer-Streck S, Hemmerich P, Kiehntopf M, Zamboni N, Englert C, Guthke R, Kaleta C, Platzer M, Sühnel J, Witte OW, Zarse K, Ristow M. (2015), Nature communications, 6, 10043. https://doi.org/10.1038/ncomms10043
2014-2010
Pro-apoptotic function of GABA-related transcripts following stroke. Jaenisch N, Popp A, Guenther M, Schnabel J, Witte OW, Frahm C. (2014), Neurobiology of disease, 70, 237–244. https://doi.org/10.1016/j.nbd.2014.06.015
Age-specific transcriptional response to stroke. Sieber MW, Guenther M, Jaenisch N, Albrecht-Eckardt D, Kohl M, Witte OW, Frahm C. (2014), Neurobiology of aging, 35(7), 1744–1754. https://doi.org/10.1016/j.neurobiolaging.2014.01.012
Impact of indomethacin on neuroinflammation and hippocampal neurogenesis in aged mice. Boehme M, Guenther M, Stahr A, Liebmann M, Jaenisch N, Witte OW, Frahm C. (2014), Neuroscience letters, 572, 7–12. https://doi.org/10.1016/j.neulet.2014.04.043
Astrocytic Cx43 and Cx30 differentially modulate adult neurogenesis in mice. Liebmann M, Stahr A, Guenther M, Witte OW, Frahm C. (2013), Neuroscience letters, 545, 40–45. https://doi.org/10.1016/j.neulet.2013.04.013
Attenuated inflammatory response in triggering receptor expressed on myeloid cells 2 (TREM2) knock-out mice following stroke. Sieber MW, Jaenisch N, Brehm M, Guenther M, Linnartz-Gerlach B, Neumann H, Witte OW, Frahm C. (2013), PloS one, 8(1), e52982. https://doi.org/10.1371/journal.pone.0052982
Morg1(+/-) heterozygous mice are protected from experimentally induced focal cerebral ischemia. Stahr A, Frahm C, Kretz A, Bondeva T, Witte OW, Wolf G. (2012), Brain research, 1482, 22–31. https://doi.org/10.1016/j.brainres.2012.09.017
Age dependence of excitatory-inhibitory balance following stroke. Schmidt S, Bruehl C, Frahm C, Redecker C, Witte OW. (2011), Neurobiology of aging, 33(7), 1356–1363. https://doi.org/10.1016/j.neurobiolaging.2010.11.019
Attenuated inflammatory response in aged mice brains following stroke. Sieber MW, Claus RA, Witte OW, Frahm C. (2011), PloS one, 6(10), e26288. https://doi.org/10.1371/journal.pone.0026288
Substantial performance discrepancies among commercially available kits for reverse transcription quantitative polymerase chain reaction: a systematic comparative investigator-driven approach. Sieber MW, Recknagel P, Glaser F, Witte OW, Bauer M, Claus RA, Frahm C. (2010), Analytical biochemistry, 401(2), 303–311. https://doi.org/10.1016/j.ab.2010.03.007
Inter-age variability of bona fide unvaried transcripts Normalization of quantitative PCR data in ischemic stroke. Sieber MW, Guenther M, Kohl M, Witte OW, Claus RA, Frahm C. (2010), Neurobiology of aging, 31(4), 654–664. https://doi.org/10.1016/j.neurobiolaging.2008.05.023
Downregulation of potassium chloride cotransporter KCC2 after transient focal cerebral ischemia. Jaenisch N, Witte OW, Frahm C. (2010), Stroke, 41(3), e151–e159. https://doi.org/10.1161/STROKEAHA.109.570424
2009-2005
Identification of ischemic regions in a rat model of stroke. Popp A, Jaenisch N, Witte OW, Frahm C. (2009), PloS one, 4(3), e4764. https://doi.org/10.1371/journal.pone.0004764
Adult and embryonic GAD transcripts are spatiotemporally regulated during postnatal development in the rat brain. Popp A, Urbach A, Witte OW, Frahm C. (2009), PloS one, 4(2), e4371. https://doi.org/10.1371/journal.pone.0004371
Loss of GABAergic neurons in the subiculum and its functional implications in temporal lobe epilepsy. Knopp A, Frahm C, Fidzinski P, Witte OW, Behr J. (2008), Brain: a journal of neurology, 131(Pt 6), 1516–1527. https://doi.org/10.1093/brain/awn095
Synaptic responses in superficial layers of medial entorhinal cortex from rats with kainate-induced epilepsy. Tolner EA, Frahm C, Metzger R, Gorter JA, Witte OW, Lopes da Silva FH, Heinemann U. (2007), Neurobiology of disease, 26(2), 419–438. https://doi.org/10.1016/j.nbd.2007.01.009
Up-regulation of Connexin43 in the glial scar following photothrombotic ischemic injury. Haupt C, Witte OW, Frahm C. (2007), Molecular and cellular neurosciences, 35(1), 89–99. https://doi.org/10.1016/j.mcn.2007.02.005
Temporal profile of connexin 43 expression after photothrombotic lesion in rat brain. Haupt C, Witte OW, Frahm C. (2007), Neuroscience, 144(2), 562–570. https://doi.org/10.1016/j.neuroscience.2006.09.054
The combined use of non-radioactive in situ hybridization and real-time RT-PCR to assess gene expression in cryosections. Haupt C, Tolner EA, Heinemann U, Witte OW, Frahm C. (2006), Brain research, 1118(1), 232–238. https://doi.org/10.1016/j.brainres.2006.08.037
Stable expression of the vesicular GABA transporter following photothrombotic infarct in rat brain. Frahm C, Siegel G, Grass S, Witte OW. (2006), Neuroscience, 140(3), 865–877. https://doi.org/10.1016/j.neuroscience.2006.02.045
Regulation of GABA transporter mRNA and protein after photothrombotic infarct in rat brain. Frahm C, Haupt C, Weinandy F, Siegel G, Bruehl C, Witte OW. (2004), The Journal of comparative neurology, 478(2), 176–188. https://doi.org/10.1002/cne.20282
2004-1998
Astrocytic Connexin 43 mRNA is Upregulated in the Vicinity of the Photothrombotic Lesion in Rat Brain. Haupt C, Witte OW, and Frahm C. (2004), Klinische Neurophysiologie, 35(03). doi: 10.1055/s-2004-832006.
Ionotropic GABA receptors with mixed pharmacological properties of GABAA and GABAC receptors. Hartmann K, Stief F, Draguhn A, Frahm C. (2004), European journal of pharmacology, 497(2), 139–146. https://doi.org/10.1016/j.ejphar.2004.06.044
GABA neurons survive focal ischemic injury. Frahm C, Haupt C, Witte OW. (2004), Neuroscience, 127(2), 341–346. https://doi.org/10.1016/j.neuroscience.2004.05.027
Transmitter-Konzentration und synaptische Hemmung bei Epilepsie, Draguhn A, Hartmann K, Stief F, Frahm C, Engel D. (2003), Zeitschrift für Epileptologie, 16(3), 223–228. doi: 10.1007/s10309-003-0026-4.
Unaltered control of extracellular GABA-concentration through GAT-1 in the hippocampus of rats after pilocarpine-induced status epilepticus. Frahm C, Stief F, Zuschratter W, Draguhn A. (2003), Epilepsy research, 52(3), 243–252. https://doi.org/10.1016
GAD and GABA transporter (GAT-1) mRNA expression in the developing rat hippocampus. Frahm C, Draguhn A. (2001), Brain research. Developmental brain research, 132(1), 1–13. https://doi.org/10.1016/s0165-3806(01)00288-7
Plasticity of rat central inhibitory synapses through GABA metabolism. Engel D, Pahner I, Schulze K, Frahm C, Jarry H, Ahnert-Hilger G, Draguhn A. (2001), The Journal of physiology, 535(Pt 2), 473–482. https://doi.org/10.1111/j.1469-7793.2001.00473.x
Efficacy of background GABA uptake in rat hippocampal slices. Frahm C, Engel D, Draguhn A. (2001), Neuroreport, 12(8), 1593–1596. https://doi.org/10.1097/00001756-200106130-00016
Presence of gamma-aminobutyric acid transporter mRNA in interneurons and principal cells of rat hippocampus. Frahm C, Engel D, Piechotta A, Heinemann U, Draguhn A. (2000), Neuroscience letters, 288(3), 175–178. https://doi.org/10.1016
Acute effects of gamma-vinyl-GABA on low-magnesium evoked epileptiform activity in vitro. Engel D, Endermann U, Frahm C, Heinemann U, Draguhn A. (2000), Epilepsy research, 40(2-3), 99–107. https://doi.org/10.1016/s0920-1211(00)00112-1
Age-dependence of the anticonvulsant effects of the GABA uptake inhibitor tiagabine in vitro. Sabau A, Frahm C, Pfeiffer M, Breustedt J, Piechotta A, Numberger M, Engel D, Heinemann U, Draguhn A. (1999), European journal of pharmacology, 383(3), 259–266. https://doi.org/10.1016
Laminar difference in GABA uptake and GAT-1 expression in rat CA1. Engel D, Schmitz D, Gloveli T, Frahm C, Heinemann U, Draguhn A. (1998), The Journal of physiology, 512 ( Pt 3)(Pt 3), 643–649. https://doi.org/10.1111/j.1469-7793.1998.643bd.x
|
Source |
Title |
Period |
| DFG FR 1264/10-1 | A humanized mouse model to analyse the age-dependent impact of gut microbiota on microglial diversity in the brain | 2022-2025 |
|
IMPULS |
Identifizierung und Manipulation der physiologischen und psychologischen Uhren der Lebensspanne | 2021-2026 |
| H2020-MSCA-ITN-2019 SmartAge | Gut-brain-axis: Targets for improvement of cognition in the elderly | 2020-2024 |
|
DFG FR 1264/6-1 |
Epigenom-Mikrobiom-Crosstalk: Ein neuer Ansatz um kognitive Fähigkeiten im Alter zu erhalten. | 2019-2021 |
|
RTG Jena School Moleular Medicine |
Function of the Ca2+-regulated actin nucleator Cobl in cellular plasticity following stroke. | 2018-2021 |
|
RTG Jena School Moleular Medicine |
The actin nucleator Cobl as target in excitotoxicity induced by ischemic stroke. | 2015-2018 |
|
GERONTOSYS – JenAge BMBF |
Systembiologie von mildem Stress beim gesunden Altern – ein Multi-Spezies Ansatz | 2009-2014 |
|
UKJ ProChance 2009 |
Bedeutung embryonaler Splicevarianten von GAD67 für Neurogenese und post-ischämische Reorganisation | 2010-2012 |
|
STREP, FP6-2004-LIFESCIHEALTH- |
Age-dependent inflammatory response after stroke (ARGES) |
2007-2010 |
|
UKJ IZKF |
Untersuchungen zur Beteiligung des Connexin43 am Prozess der reaktiven Astrogliose |
2006-2007 |
|
DFG Fr 1264/2-1 |
Beteiligung des Connexin43 am Prozess der reaktiven Astrogliose nach fokaler zerebraler Ischämie |
2007-2010 |
Mitarbeiter Labor
Dr. Rowena Simon
Dr. Julia Lindner
Dr. Fabienne Haas
Madlen Haase (Dipl. Ing)
Raphaëlle Petit (PhD Student)
Alumni
Dr.rer.nat. Corinna Haupt
Dr.rer.nat. Anna Stahr
Dr.rer.nat. Nadine Jänisch
Dr.rer.nat. Matthias Sieber
Dr.rer.nat. Anke Popp
Dr.rer.nat. Akash Srivastava (Co-supervisor)
Dr.rer.nat. Yuanyuan Ji (Co-supervisor)
Dr.med. Robert Zünder
Marcus Böhme (Diplom)
Gabriele Siegel (Diplom)
Jule Müller (Diplom)
Marie Liebmann (Diplom)
Martin Brehm (Diplom)
Madlen Günther (Diplom)
Jennifer Behler (Diplom)
Maria Knyrim (MSc)
Ivana Radulović (MSc, Co-supervisor)
Martin Möller (BSc)
Jakob Scharnholz (BSc)
Marie-Luise Ederer (MD)

Multiple Myeloma (MM) is the second most frequent hematologic malignancy after lymphomas. MM is a disease of the elderly population; the median age at diagnosis is 69 years and more than one third of the patients is older that 75 years at the time of diagnosis. With the constant aging of the general population the incidence of MM is expected to constantly increase. MM has specific characteristics that makes it unique among hematological cancer. An important feature of MM is that its development follows a multistep process, from the premalignant condition of monoclonal gammopathy of undetermined significance, to the inactive stage of smoldering MM, the active stage of MM, to the final stage of plasma cell leukemia or extramedullary MM. Another very important characteristic is the dependence of the MM cells for their growth and survival on the interaction with the microenvironment. Although the importance of the microenvironment in the development of MM has long been recognized, the exact mechanism of the interaction between microenvironment and MM cells is not fully understood. We hypothesize that disease progression is influenced by the microenvironment and specifically by molecular changes in bone marrow stromal cells (BMSCs). To test our hypothesis, BMSCs derived from MM patients in different disease phases, will be molecularly investigated to find differences that can be responsible of disease progression. To assess the interaction between BMSCs and MM cells, patients-derived BMSCs will be co-cultured with MM cell lines. Identification of differences in BMSCs from different disease stages as well as in MM cells co-cultured with those BMSCs will provide a deeper insight into the role of the BM microenvironment in MM pathobiology. Results will likely allow for the postulation of new therapeutic targets to stop or delay disease progression fostered by the microenvironment.
Impact of Prenatal Stress on brain ageing
Fetal programming, undernutrition and stress
Our Mission
Slowing brain ageing and susceptibility to age-associated diseases:
Early programming of pathways and genes and late interventional targets.


Committed to healthy brain ageing from the very beginning
A healthy brain is a major determinant of good life-long health. Human epidemiological and animal studies indicate that in addition to life style and genetic factors, environmental influences in prenatal life have a major impact on brain ageing and age-associated brain disorders.
Our consortium consists of leading European and US-American neuroscientists, physiologists, obstetricians, developmental psychologists and innovative biotech companies.
Our project will determine structural and functional indicators of brain age. We examine to what extent prenatal stress, i.e. maternal stress, glucocorticoid treatment or malnutrition, mediate premature brain ageing and susceptibility to age-associated brain disorders such as cognitive decline and stroke.
We dissect mechanisms and pharmacological interventions which may be used in elderly people. Information obtained will allow identification of people at risk for premature brain ageing and offer therapeutic interventions.
Human epidemiological and animal studies indicate that in addition to life style and genetic factors, environmental influences in prenatal life have a major impact on brain ageing and age-associated brain disorders. We hypothesize that: (1) prenatal stress i.e. maternal stress, treatment with stress hormones (glucocorticoids) and undernutrition programs early brain ageing; (2) this predisposes to age-associated brain diseases including cognitive decline and stroke; (3) epigenetic changes affecting glucocorticoid receptor sensitivity, altered autonomic nervous system reactivity and altered cerebrovascular tone are important mediators of these processes, (4) these changes represent targets for diagnosis, preventive measures and therapeutic interventions. Stress is increasingly prevalent in today’s society and a stress sensitive brain is particularly vulnerable for an early loss of brain resilience to challenges.

Our consortium has unique access to well-defined human and non-human primate cohorts at different ages from early childhood to the elderly that have been exposed to different types of prenatal stress. For experimental analysis of mechanisms of prenatal programming, we apply innovative techniques to characterize brain ageing, namely MRI based volumetry, non-linear analysis of EEG and autonomous activity, advanced molecular techniques including epigenetics, metabolomics and neuropsychological as well as behavioral tests.
Effects and mechanisms of prenatal programming
The relationship between prenatal programming and ageing is undoubtedly complex involving several factors, pathways and mechanisms which appear to be critical for early brain ageing. We concentrate on linking early developmental processes with longevity and ageing with a special focus on genes and pathways. In an integrated and translational approach, this project addresses the key question “How sensitive is the stress axis to major environmental stimuli during pregnancy and how persistent are the changes throughout the entire life-span including ageing?” The project analyzes to what extent glucocorticoid receptor resistance, increased sympathetic activity, or increased cerebrovascular tone are key mediators connecting developmental modifications to early brain ageing and increased susceptibility to age-associated brain disorders in experimental studies. We will show to what extent prenatal stress programs early cognitive decline together with incidence and outcome of stroke in aged subjects. We compare the impact of different types of prenatal stress: maternal psychophysiological stress, undernutrition, and therapeutic exposure to stress hormones (glucocorticoids). The results achieved in the project will reveal to what extent the different types of prenatal stress program early brain ageing.
We have access to some of the best characterized human cohorts at different ages from early childhood to the elderly that have been exposed to prenatal stress to examine and compare the effects of major prenatal environmental factors (maternal stress, GC exposure and nutrient restriction) on structural and functional brain development and ageing, and on the predisposition for brain-related diseases (early cognitive decline and stroke).
The corresponding use of non-human primate cohorts and rodents and transgenic mice offers a truly unique opportunity to translate experimental results to humans.
Determination of BrainAge
Each one of us has experienced that perceived (biological) age may notably differ from the numerical age even when features related to ageing such as wrinkles, gray hair or lip height are not accounted for. The same applies for cognitive function or brain atrophy even in the absence of disease. Apart from the question as to why the appearance of ageing is so varied, the foremost issue that concerns us is how to measure brain age. BRAINAGE is a consortium that brings European expertise together to determine biological brain age at a structural, functional and metabolic level.
In order to determine the effect of major prenatal stress on brain development and brain ageing, the project aims to develop structural and functional indicators and metabolic, genetic and immune markers of brain ageing. The project employs innovative and standardized techniques (MR morphology, neuropsychology, neurophysiological parameters, blood markers) to measure biological brain age. We identify these indicators and markers in rodents and use non-human primates to translate the use of these markers for the human situation. This will allow us to identify human beings at risk.
Prevention and intervention
The goal is to develop preventive measures early in development as well as therapeutic interventions for conditions that are still reversible to support healthy brain ageing in subjects at risk. This goal is based on experimental analyses of the underlying mechanisms via a translational approach in humans, non-human primates, and rodents. We will identify pharmacological interventions that may reverse altered stress sensitivity and vasoreactivity in rodents as a base for preventive or therapeutic human studies.

Efforts towards achieving an increased healthy lifespan have a long history and have inspired mankind over the centuries. In one of the earliest known literary works, the Epic of Gilgamesh, the hero sets out on a long and dangerous journey to search for the secret of eternal life to be found in a plant somewhere at the bottom of an ocean.
Today, in view of the worldwide ageing population, understanding the biology of healthy ageing is more relevant than ever. Healthy brain ageing is a major determinant of quality life-long health, since typical age-associated diseases are brain disorders such as cognitive decline, dementia or stroke. Stroke is the third most common cause for disability and invalidism in Europe. Apart from the element of personal tragedy, this situation also has socioeconomic implications: costs for preventive measures, treatment, rehabilitation as well as care consume 4% of the national health budgets. This figure is expected to rise with increase in life expectancy.
A major goal of the European Community is to find ways to ensure that increase in longevity is also accompanied by an improvement in disease-free life expectancy. The question is how can preventive and therapeutic measures delay the onset of typical age-associated diseases? To answer this question, we need to better understand the roots of health and disease in later life.
Human epidemiological and animal studies indicate that in addition to life style and genetic factors, environmental influences in prenatal life have a major impact on brain ageing and age-associated brain disorders.
The first indication that ageing may already start in the womb came from a study performed almost 20 years ago in Hertfordshire which showed that people born small lived shorter lives than people who were born larger. Studies in numerous populations worldwide have since shown that a small size at birth, which serves as a proxy of the suboptimal early life experiences is associated with increased risks of chronic degenerative diseases such as type 2 diabetes, cardiovascular disease, several forms of cancer, chronic obstructive airways disease, osteoporosis and sarcopenia. It was hypothesized that adaptations made by the fetus in response to undernutrition result in permanent changes in physiology and metabolism that later induce chronic degenerative disease. The first direct evidence for this hypothesis in humans has come from the studies by Roseboom’s group showing that prenatal exposure to the Dutch famine may lead to an increased risk for type 2 diabetes, cardiovascular disease, breast cancer, renal and lung diseases.
It is well established now that epigenetic modifications during the fetal period induced by maternal stress, therapies with stress hormones (glucocorticoids) or nutrient restriction have a significant impact on health for the entire duration of an individual’s life. Analysis of this link is the key to identifying preventive and therapeutic procedures. Hence, in the present project, the focus is placed on analyzing the link between human development and brain ageing and age-associated diseases such as cognitive decline and stroke.
Prenatal stressors
There is only sparse knowledge available on the effects of the different prenatal stressors on brain structure and function during ageing. Stress sensitivity is programmed prenatally mainly due to maternal stress, stress hormone (glucocorticoid treatment) and nutrient restriction. Many questions on how timing, type, intensity, and duration of environmental disturbances are related to altered neurobehavioral development and early brain ageing still remain unanswered.
Maternal stress during pregnancy
Indications that maternal stress results in alteration of cognitive functioning, behavioral and emotional problems are to be had from human cohorts aged up to 30y from van den Bergh's group. Other studies focusing on offspring CNS structures or structure-functioning relationships following maternal stress during pregnancy have shown altered brain function at the neurophysiological level in the newborn and gray matter volume reductions in the 6-9y old offspring at the structural level. The fact that maternal anxiety and stress during human pregnancy is linked with behavior abnormalities during childhood and adolescence, even after controlling for effects of postnatal maternal mood and other relevant prenatal and post-natal confounders, suggests that, as in animal models, a programming effect on the fetal brain had taken place.
Glucocorticoid treatment during pregnancy
Almost 10% of all pregnant women threatening preterm delivery are treated with glucocorticoid to enhance fetal lung maturation. This treatment ensures that preterm babies can artificially be ventilated and leads to survival.
Numerous effects of prenatal glucocorticoid treatment at doses used clinically to enhance fetal lung maturation on brain development and brain function during later life were observed in rodents, sheep and non-human primates in the studies from Nathanielsz's and Schwab's groups. In contrast, the effects of prenatal glucocorticoid exposure are much less clear in humans. There is one exception which refers to the few studies that followed-up offspring until the age of 32y and who showed no behavior or neurocognitive abnormalities after one course of prenatal betamethasone. Multiple courses of betamethasone to enhance fetal lung maturation, however, induced abnormalities of functional brain development and behavior disorders between 3 and 6 years of age.
In addition to direct effects of increased stress sensitivity on neuronal activity complex, there is evidence that indirect effects may also play a role. For example, resistance of peripheral glucocorticoid receptors to immunosuppressive GC leads to a pro-inflammatory state that has negative effects on neuronal function.
Nutrient restriction
Moderate undernutrition during pregnancy is common in both developing countries and in western societies such as the EU. In industrialized countries, a lifestyle comprising of dieting (including global food reduction) for cosmetic purposes is widespread and is a common cause of moderate undernutrition. A recent study showed that most women do not improve their dietary and lifestyle patterns during pregnancy. Finally, poor fetal nutrition is also present in teenage and in elderly primigravid pregnancies.
Roseboom's group has shown in the Dutch famine cohort and Nathanielsz's and Schwab's groups have shown in non-human primates that maternal malnutrition during pregnancy have effects on cognition that were independent of size and weight at birth. The evidence obtained recently by Roseboom's group from the mid-fifties suggests that cognitive function may also deteriorate faster in those prenatally exposed to the famine in early gestation, but not among those exposed in late gestation. In the British 1946 birth cohort, birth weight was positively associated with cognition in adult age.
There is no precise understanding of how prenatal stress induces cognitive disturbances in later life. Both a changed activity of the stress system and a different trajectory of brain development are likely.
Programming of stress sensitivity
Stress sensitivity depends on the activity of the stress axis with the two limbs, the autonomous nervous system and the hypothalamo-pituitary adrenal axis. The current (somewhat simplified) concept is that stress sensitivity is programmed prenatally in the last third of gestation when the hypothalamo pituitary adrenal axis matures. If, at this time fetal glucocorticoid concentrations are higher than appropriate for the current stage of maturation, glucocorticoid receptor expression and sensitivity in the hippocampus and hypothalamus, both critical for normal negative feedback to "turn off" the stress response, are permanently reduced by epigenetic modification of the glucocorticoid receptor genes. These mechanistic changes result in hypothalamo pituitary adrenal axis hyperdrive in the presence of glucocorticoid receptor resistance in many animal studies. Importantly, prenatal stress does not only alter activity of the hypothalamo-pituitary adrenal axis permanently, but also changes activity of the second limb of the stress axis, the autonomic nervous system.
Apart from this general mechanism, we do not have a detailed understanding of how the stress axis in later life is altered after prenatal stress. For example, following prenatal stress exposure, human and animal studies show that the HPA axis and the ANS are even less active during certain stages of life. Generally, effects of prenatal stress on stress sensitivity during later life seem to depend on poorly determined conditions such as stress sensitive periods during early life, the amount of stress, and the adversity of the stressor.
Effects of increased stress sensitivity
Hypothalamo-pituitary adrenal axis hyperactivity leads to increased stress sensitivity. Increased stress sensitivity contributes to biological ageing through both excessive catecholamine and glucocorticoid secretion and through glucocorticoid receptor resistance. The latter increases the production of pro-inflammatory cytokines, accentuating potential neuronal damage. There are hints that prenatal stress may not only affect brain ageing but also predispose to brain-related diseases. Data from Roseboom's group from the Dutch famine cohort suggest that the cognitive function may deteriorate faster in those subjects who were prenatally exposed to the famine.
Van den Bergh's group is the only group who has tested whether the hypothalamo-pituitary adrenal axis mediates the link between prenatal maternal stress and offspring behavioral problems in humans. It was shown in the 15-year-old offspring that maternal anxiety during weeks 12 to 22 of pregnancy is associated with a high flattened diurnal cortisol profile that shows elevated cortisol secretion in the evening.
Moreover, the interaction of increased stress sensitivity and the serotonergic system may explain the occurrence of depressive disorders since cortisol inhibits this amine system. Indeed, van den Bergh's group has shown an effect of prenatal anxiety on depressed mood that, in part, can be due to a flattened cortisol profile. Depression can impact on the objective age-related cognitive impairment.
Changes in the trajectory of brain development
Maternal stress, glucocorticoid treatment and nutrient restriction during pregnancy may also change the trajectory of fetal brain development. Nathanielsz's and Schwab's groups have shown that prenatal glucocorticoid treatment at the clinical dose used to enhance fetal lung maturation affects neurogenesis and myelination in fetal sheep. Studies in rodents clearly show that nutrient restriction alters brain development and cognitive function in later life. Nathanielsz's and Schwab's groups have shown that even moderate maternal undernutrition affects neurogenesis and development of neuronal network formation in the fetal non-human primate. Similarly, abnormalities in brain structure were found in schizophrenic patients exposed to the Dutch famine winter.
While early intervention is desirable (prevention of stress in the womb), it is also necessary to identify treatment strategies for those individuals who have an increased risk for early brain ageing and age-associated brain disease. Currently, there are millions of people in the EU and all over the world who are already struggling with the effects of prenatal stress on their health. This population also needs targeted interventions.

Bea van den Bergh´s group is involved in developmental neuroscience and biological developmental psychology. She is a pioneer in studying the developmental origins of behavior, adding to the efforts of researchers worldwide who are working on the developmental origins of health and disease. Study of the Developmental Origins of Behavior, Health and Diseases (DOBHaD) addresses timely and much needed research issues related to the interface between medical and behavioral sciences. Her DOBHaD research program focuses on physiological and psychological processes and their interplay; thus, contributing to the understanding of mechanisms underlying DOBHaD and enhancing care for infants, children and adolescents with a prenatally acquired vulnerability for behavioural problems, psychopathology or chronic medical conditions. More specific goals are:
Christian Gaser leads the group on Structural Brain Mapping at the Dept. of Neurology. He has substantial experience to plan, perform, and lead independent and internationally distributed research projects. This is particularly documented by the achievements of his Independent Junior Research Group ”Neuroimaging” which has contributed to scientific progress in a wide range of topics in neuroscience, often working across field boundaries. His research group is supported by the Federal Ministry of Education and Research (BMBF) to develop and apply methods for patient classification using computational morphometry. He has carried out a great amount of work in the field of neuroimaging with a specific focus on the development of valuable analysis methods for structural brain data. Amongst these methods, he has developed and implemented the VBM (voxel-based morphometry) toolboxes as an extension to the algorithms used by SPM8 (Wellcome Department of Cognitive Neurology), the software package that is the central processing software for MR morphometry of this project. In addition, he has pioneered the analysis of use-dependent plasticity. Furthermore, he uses state-of-the-art techniques to assess the stage of age progression by estimating the individual BrainAGE scores with applications for the early detection of Alzheimer’s disease.
Biocrates is a leading biotech company in the field of metabolic biomarker research and kit development. Using a targeted, mass spectrometry-based metabolomics approach, Biocrates identifies and quantifies endogenous metabolites in body fluid or tissue samples and develops them into powerful biomarkers. Biocrates has a strong background in biological sciences and (bio-) informatics as well as long-standing experience in analytical method development, method application, data analysis, and project management. Biocrates is well equipped with a state-of-the-art mass spectrometry platform that, in combination with its comprehensive methodological knowledge, allows the accurate quantification of a vast range of metabolites across several biochemical classes in a targeted metabolomics approach. Biocrates has been involved in various international and national research consortia and by applying its analytical services, directly contributed to neonatal research projects like e.g. the EU-funded NEOBRAIN project.
Dr. Peter Nathanielsz, formerly director of the Center for Pregnancy and Newborn Research at the University of Texas Health Sciences Center, is now the Distinguished Research Professor of Life Course Studies within the UW College of Agriculture and Natural Resources´ Department of Animal Science.
Peter W. Nathanielsz has researched fetal development for over forty years and was recently named as one of the top 5% of funded NIH investigators in the United States. For his work on fetal development he has been made a Fellow ad Eundem of the Royal College of Obstetricians in England. He delivered the 2011 Messenger Lectures at Cornell University, that university’s highest scientific recognition. He wrote the first book for the general reader on Developmental Programming entitled Life in the Womb: The origin of health and disease, published in 1999.
The group is the only one in the world owning adult non-human primate cohorts that were prospectively exposed to different prenatal stressors (glucocorticoid exposure and nutrient restriction) and are dedicated to study Developmental Programming of Health and Disease in later life.
His mission is to understand the molecular mechanisms that underlie the ageing process and that lead to age-related diseases with the hope that eventually this knowledge can contribute to a more healthy ageing of the human population. Cooperating with clinical partners, the group is involved in detection and functional analyses of genetic & epigenetic variations that determine the individual susceptibility to complex disorders (inflammation, obesity, cancer) and ageing. They are also engaged in the sequence analysis of eukaryotic model organisms, prokaryotic genomes and metagenomes. The group is one of the first laboratories in Germany applying next-generation sequencing for genome and transcriptome analysis.
Dr. Juan Camilo Estrada received his Bachelor in Biochemistry from the Autonomous University of Madrid. He earned his Ph.D. in Molecular Biology at the prestigious National Center for Cardiovascular Diseases (CNIC). During his Ph.D. program he focused in the study of oxidative stress on genetic stability and biosafety of human stem cells for his therapeutic application. After his doctorate, he specialized in the study of non-canonical activity of telomerase in the cell metabolism and senescence. His works has allowed him to participate in various international conferences and publish several scientific articles in the arena of regenerative medicine and ageing, and develop a patent to identifying new genetic and transcriptional biomarkers of cellular senescence in culture. Dr. Estrada has extensive experience in the field of human molecular cytogenetic with strong handling of different probes (PNA, CEP and LSI) for the chromosome labeling by classic fluorescence in situ hybridization (FISH) and derived techniques as multicolor FISH (M-FISH) and quantitative FISH (Q-FISH).
The AMC is one of the most prominent medical centers in the Netherlands with a leading position in medical research, both nationally and internationally. Tessa Roseboom is one of the AMC´s Principal Investigators leading the Fetal Origins Research group within the Academic Medical Center. She obtained funding from the Dutch Heart Foundation, the Netherlands Organisation for Scientific Resaerch, The European Science Foundation (Eurostress Program), Medical Resaerch Courncil and the Diabetes Fund with a volume of nearly 1 million Euros. She established the healthy WOMB study center to investigate the role of various influences during early human development on later health.
She has long standing experience in studying the early origins of later disease. She has worked on the Dutch famine birth cohort study for the past 15 years, and has led that study during the past 10 years. This cohort consists of 2.414 singletons who were born around the time of the Dutch famine in 1944-45. The cohort has been followed up extensively, focussing not only on metabolic and cardiovascular disease, but also on psychiatric diseases, infections, wellbeing, and certain types of cancer. She was the first to demonstrate that undernutrition during gestation in humans is associated with a doubled rate of heart disease, and of late, she also found suggestions of earlier brain ageing. She has been involved in investigateing research into gene environmental interactions, transgenerational effects, and outcome on reproductive succcess and epigenetic mechanisms.
Matthias Schwab is a trained pathophysiologist and neurologist. He is a senior member of the Department of Neurology and Head of the Research Group 'Fetal Brain Development and Programming of Diseases in Later Life' for more than 15y and strongly committed to the link between human development and ageing. His focus is on fetal brain development and the programming of brain-related disorders with a strong emphasis on stress effects and inflammation. He represents one of the first scientist who dealt with effects of prenatal glucocorticoid exposure on the brain using large animal models. He has a long-standing and successful cooperation with many partners in Europe and worldwide which have resulted in many joint publications. Prof. Schwab is head of the interdisciplinary sleep research unit with focus on autonomous and vascular dysregulation during prenatal development of sleep and during ageing. He has developed innovative nonlinear methods of EEG analysis.
Jan Tuckermann and his group’s aim is the deeper understanding of the action of GCs via their nuclear receptor (GR) in age-related processes. They use a combinatorial approach employing functional characterization of mouse strains conditionally mutated both in the GR and selected target genes in disease models, together with the development of functional screening tools for relevant cell types in age-related disorders. Here the goal is to decipher new mechanisms and to identify new mediators of therapeutic and side effects of GCs. Thus, by understanding GC-mediated effects in organs and tissues, knowledge about about degenerative processes during ageing can be acquired.










coming soon

Es mehren sich die Hinweise, dass Umwelteinflüsse wie Stress und Mangelernährung während der frühen Entwicklung im Mutterleib einen wesentlichen Einfluss auf die Gesundheit im späteren Leben haben. Die durch diese Umwelteinflüsse induzierten epigenetischen Veränderungen tragen zur Prädisposition für „Volkskrankheiten“ wie Depressionen, Adipositas und kardiovaskulären Erkrankungen bei. Die epigenetischen Veränderungen erklären auch die Persistenz dieser Erkrankungen über Generationen und die schlechte Wirksamkeit präventiver oder interventioneller Maßnahmen im Erwachsenenalter.



Wie schon die Erfahrung jeder Mutter zeigt, wechseln in utero Phasen der Ruhe mit Phasen der körperlichen Aktivität. Diese Verhaltensänderungen reflektieren die fetalen Schlafstadien. Wir untersuchen die Entwicklung der fetalen Schlafstadien als globaler Marker für den Entwicklungsstand der Hirnfunktion.

Heftige mütterliche Bewegungen oder äußere Geräusche werden durch den Fetus mit ausgeprägten Körperbewegungen aber auch mit Änderungen der Herzfrequenz, Augen- und Atembewegungen beantwortet. Unser Verständnis, wann und wie sich Hören und Fühlen im Mutterleib entwickelt und welche Bedeutung Umweltreize für die fetale Hirnentwicklung haben, ist noch marginal.
Ziel unserer Untersuchungen ist besser zu verstehen,

Wesentliche Umwelteinflüsse, die die Gesundheit im späteren Leben determinieren, sind mütterlicher Stress, Mangelernährung und Obesitas während der Schwangerschaft, denn sie können zu dauerhaften Modifikationen von physiologischen Systemen wie der Stressachse oder des Verdauungssystems führen. Auf mechanistischer Ebene induzieren diese Umwelteinflüsse Veränderungen der Reifung fetaler Organsysteme wie des Gehirns, des kardiovaskulären, metabolischen oder Immunsystems. Zum Beispiel führen funktionelle Anpassungen des Feten an Stress zu einer erhöhten Stresssensitivität und ermöglichen eine Adaptation an eine feindliche Umgebung nach der Geburt. Eine intrauterine Mangelernährung bewirkt eine Programmierung auf guter „Futterverwerter“ und sichert das Überleben bei Nahrungsmangel. Diese Anpassungen haben jedoch auch pathogenetisches Potential insbesondere wenn die „erwarteten“ Umweltbedingungen nicht eintreffen. Eine erhöhte Stressempfindlichkeit kann zu stressassoziierten Erkrankungen wie neuropsychiatrischen Auffälligkeiten (kognitive Störungen, ADHS, Depressionen) oder kardiovaskulären Erkrankungen (Herzinfarkte, Schlaganfälle) führen. Eine zu gute „Futterverwertung“ kann bei normaler Nahrungszufuhr metabolische Störungen (Diabetes, Obesitas) induzieren. Aber auch adipöse Mütter können eine Prädisposition für Obesitas „vererben“. Dies geschieht möglicherweise über Veränderungen im kindlichen Mikrobiom. Veränderungen der Hirnentwicklung, die alle drei Umwelteinflüsse potentiell induzieren, können zu Einbußen in der kognitiven Leistungsfähigkeit führen.
Wir beschäftigen uns insbesondere mit
Die Ergebnisse experimenteller Untersuchungen an Nagermodellen und im chronisch instrumentierten fetalen Schaf werden in klinischen Kohortenstudien verifiziert (von bench to bedside). Umgekehrt werden die Mechanismen von in klinischen Kohortenstudien gefundenen Effekten experimentell untersucht, um frühe präventive Maßnahmen zu entwickeln.


Die intrauterine hypoxische Hinschädigung (zerebrale Leukomalazie) und damit assoziierte Hirnblutungen werden durch eine Exposition gegenüber Glukokortikoiden beeinflusst. Wir beschäftigen uns mit den darunter liegenden Pathomechanismen.
Impact of Prenatal Stress on brain ageing
Fetal programming, undernutrition and stress
Our Mission
Slowing brain ageing and susceptibility to age-associated diseases:
Early programming of pathways and genes and late interventional targets.


Committed to healthy brain ageing from the very beginning
A healthy brain is a major determinant of good life-long health. Human epidemiological and animal studies indicate that in addition to life style and genetic factors, environmental influences in prenatal life have a major impact on brain ageing and age-associated brain disorders.
Our consortium consists of leading European and US-American neuroscientists, physiologists, obstetricians, developmental psychologists and innovative biotech companies.
Our project will determine structural and functional indicators of brain age. We examine to what extent prenatal stress, i.e. maternal stress, glucocorticoid treatment or malnutrition, mediate premature brain ageing and susceptibility to age-associated brain disorders such as cognitive decline and stroke.
We dissect mechanisms and pharmacological interventions which may be used in elderly people. Information obtained will allow identification of people at risk for premature brain ageing and offer therapeutic interventions.
Human epidemiological and animal studies indicate that in addition to life style and genetic factors, environmental influences in prenatal life have a major impact on brain ageing and age-associated brain disorders. We hypothesize that: (1) prenatal stress i.e. maternal stress, treatment with stress hormones (glucocorticoids) and undernutrition programs early brain ageing; (2) this predisposes to age-associated brain diseases including cognitive decline and stroke; (3) epigenetic changes affecting glucocorticoid receptor sensitivity, altered autonomic nervous system reactivity and altered cerebrovascular tone are important mediators of these processes, (4) these changes represent targets for diagnosis, preventive measures and therapeutic interventions. Stress is increasingly prevalent in today’s society and a stress sensitive brain is particularly vulnerable for an early loss of brain resilience to challenges.

Our consortium has unique access to well-defined human and non-human primate cohorts at different ages from early childhood to the elderly that have been exposed to different types of prenatal stress. For experimental analysis of mechanisms of prenatal programming, we apply innovative techniques to characterize brain ageing, namely MRI based volumetry, non-linear analysis of EEG and autonomous activity, advanced molecular techniques including epigenetics, metabolomics and neuropsychological as well as behavioral tests.
Effects and mechanisms of prenatal programming
The relationship between prenatal programming and ageing is undoubtedly complex involving several factors, pathways and mechanisms which appear to be critical for early brain ageing. We concentrate on linking early developmental processes with longevity and ageing with a special focus on genes and pathways. In an integrated and translational approach, this project addresses the key question “How sensitive is the stress axis to major environmental stimuli during pregnancy and how persistent are the changes throughout the entire life-span including ageing?” The project analyzes to what extent glucocorticoid receptor resistance, increased sympathetic activity, or increased cerebrovascular tone are key mediators connecting developmental modifications to early brain ageing and increased susceptibility to age-associated brain disorders in experimental studies. We will show to what extent prenatal stress programs early cognitive decline together with incidence and outcome of stroke in aged subjects. We compare the impact of different types of prenatal stress: maternal psychophysiological stress, undernutrition, and therapeutic exposure to stress hormones (glucocorticoids). The results achieved in the project will reveal to what extent the different types of prenatal stress program early brain ageing.
We have access to some of the best characterized human cohorts at different ages from early childhood to the elderly that have been exposed to prenatal stress to examine and compare the effects of major prenatal environmental factors (maternal stress, GC exposure and nutrient restriction) on structural and functional brain development and ageing, and on the predisposition for brain-related diseases (early cognitive decline and stroke).
The corresponding use of non-human primate cohorts and rodents and transgenic mice offers a truly unique opportunity to translate experimental results to humans.
Determination of BrainAge
Each one of us has experienced that perceived (biological) age may notably differ from the numerical age even when features related to ageing such as wrinkles, gray hair or lip height are not accounted for. The same applies for cognitive function or brain atrophy even in the absence of disease. Apart from the question as to why the appearance of ageing is so varied, the foremost issue that concerns us is how to measure brain age. BRAINAGE is a consortium that brings European expertise together to determine biological brain age at a structural, functional and metabolic level.
In order to determine the effect of major prenatal stress on brain development and brain ageing, the project aims to develop structural and functional indicators and metabolic, genetic and immune markers of brain ageing. The project employs innovative and standardized techniques (MR morphology, neuropsychology, neurophysiological parameters, blood markers) to measure biological brain age. We identify these indicators and markers in rodents and use non-human primates to translate the use of these markers for the human situation. This will allow us to identify human beings at risk.
Prevention and intervention
The goal is to develop preventive measures early in development as well as therapeutic interventions for conditions that are still reversible to support healthy brain ageing in subjects at risk. This goal is based on experimental analyses of the underlying mechanisms via a translational approach in humans, non-human primates, and rodents. We will identify pharmacological interventions that may reverse altered stress sensitivity and vasoreactivity in rodents as a base for preventive or therapeutic human studies.

Efforts towards achieving an increased healthy lifespan have a long history and have inspired mankind over the centuries. In one of the earliest known literary works, the Epic of Gilgamesh, the hero sets out on a long and dangerous journey to search for the secret of eternal life to be found in a plant somewhere at the bottom of an ocean.
Today, in view of the worldwide ageing population, understanding the biology of healthy ageing is more relevant than ever. Healthy brain ageing is a major determinant of quality life-long health, since typical age-associated diseases are brain disorders such as cognitive decline, dementia or stroke. Stroke is the third most common cause for disability and invalidism in Europe. Apart from the element of personal tragedy, this situation also has socioeconomic implications: costs for preventive measures, treatment, rehabilitation as well as care consume 4% of the national health budgets. This figure is expected to rise with increase in life expectancy.
A major goal of the European Community is to find ways to ensure that increase in longevity is also accompanied by an improvement in disease-free life expectancy. The question is how can preventive and therapeutic measures delay the onset of typical age-associated diseases? To answer this question, we need to better understand the roots of health and disease in later life.
Human epidemiological and animal studies indicate that in addition to life style and genetic factors, environmental influences in prenatal life have a major impact on brain ageing and age-associated brain disorders.
The first indication that ageing may already start in the womb came from a study performed almost 20 years ago in Hertfordshire which showed that people born small lived shorter lives than people who were born larger. Studies in numerous populations worldwide have since shown that a small size at birth, which serves as a proxy of the suboptimal early life experiences is associated with increased risks of chronic degenerative diseases such as type 2 diabetes, cardiovascular disease, several forms of cancer, chronic obstructive airways disease, osteoporosis and sarcopenia. It was hypothesized that adaptations made by the fetus in response to undernutrition result in permanent changes in physiology and metabolism that later induce chronic degenerative disease. The first direct evidence for this hypothesis in humans has come from the studies by Roseboom’s group showing that prenatal exposure to the Dutch famine may lead to an increased risk for type 2 diabetes, cardiovascular disease, breast cancer, renal and lung diseases.
It is well established now that epigenetic modifications during the fetal period induced by maternal stress, therapies with stress hormones (glucocorticoids) or nutrient restriction have a significant impact on health for the entire duration of an individual’s life. Analysis of this link is the key to identifying preventive and therapeutic procedures. Hence, in the present project, the focus is placed on analyzing the link between human development and brain ageing and age-associated diseases such as cognitive decline and stroke.
Prenatal stressors
There is only sparse knowledge available on the effects of the different prenatal stressors on brain structure and function during ageing. Stress sensitivity is programmed prenatally mainly due to maternal stress, stress hormone (glucocorticoid treatment) and nutrient restriction. Many questions on how timing, type, intensity, and duration of environmental disturbances are related to altered neurobehavioral development and early brain ageing still remain unanswered.
Maternal stress during pregnancy
Indications that maternal stress results in alteration of cognitive functioning, behavioral and emotional problems are to be had from human cohorts aged up to 30y from van den Bergh's group. Other studies focusing on offspring CNS structures or structure-functioning relationships following maternal stress during pregnancy have shown altered brain function at the neurophysiological level in the newborn and gray matter volume reductions in the 6-9y old offspring at the structural level. The fact that maternal anxiety and stress during human pregnancy is linked with behavior abnormalities during childhood and adolescence, even after controlling for effects of postnatal maternal mood and other relevant prenatal and post-natal confounders, suggests that, as in animal models, a programming effect on the fetal brain had taken place.
Glucocorticoid treatment during pregnancy
Almost 10% of all pregnant women threatening preterm delivery are treated with glucocorticoid to enhance fetal lung maturation. This treatment ensures that preterm babies can artificially be ventilated and leads to survival.
Numerous effects of prenatal glucocorticoid treatment at doses used clinically to enhance fetal lung maturation on brain development and brain function during later life were observed in rodents, sheep and non-human primates in the studies from Nathanielsz's and Schwab's groups. In contrast, the effects of prenatal glucocorticoid exposure are much less clear in humans. There is one exception which refers to the few studies that followed-up offspring until the age of 32y and who showed no behavior or neurocognitive abnormalities after one course of prenatal betamethasone. Multiple courses of betamethasone to enhance fetal lung maturation, however, induced abnormalities of functional brain development and behavior disorders between 3 and 6 years of age.
In addition to direct effects of increased stress sensitivity on neuronal activity complex, there is evidence that indirect effects may also play a role. For example, resistance of peripheral glucocorticoid receptors to immunosuppressive GC leads to a pro-inflammatory state that has negative effects on neuronal function.
Nutrient restriction
Moderate undernutrition during pregnancy is common in both developing countries and in western societies such as the EU. In industrialized countries, a lifestyle comprising of dieting (including global food reduction) for cosmetic purposes is widespread and is a common cause of moderate undernutrition. A recent study showed that most women do not improve their dietary and lifestyle patterns during pregnancy. Finally, poor fetal nutrition is also present in teenage and in elderly primigravid pregnancies.
Roseboom's group has shown in the Dutch famine cohort and Nathanielsz's and Schwab's groups have shown in non-human primates that maternal malnutrition during pregnancy have effects on cognition that were independent of size and weight at birth. The evidence obtained recently by Roseboom's group from the mid-fifties suggests that cognitive function may also deteriorate faster in those prenatally exposed to the famine in early gestation, but not among those exposed in late gestation. In the British 1946 birth cohort, birth weight was positively associated with cognition in adult age.
There is no precise understanding of how prenatal stress induces cognitive disturbances in later life. Both a changed activity of the stress system and a different trajectory of brain development are likely.
Programming of stress sensitivity
Stress sensitivity depends on the activity of the stress axis with the two limbs, the autonomous nervous system and the hypothalamo-pituitary adrenal axis. The current (somewhat simplified) concept is that stress sensitivity is programmed prenatally in the last third of gestation when the hypothalamo pituitary adrenal axis matures. If, at this time fetal glucocorticoid concentrations are higher than appropriate for the current stage of maturation, glucocorticoid receptor expression and sensitivity in the hippocampus and hypothalamus, both critical for normal negative feedback to "turn off" the stress response, are permanently reduced by epigenetic modification of the glucocorticoid receptor genes. These mechanistic changes result in hypothalamo pituitary adrenal axis hyperdrive in the presence of glucocorticoid receptor resistance in many animal studies. Importantly, prenatal stress does not only alter activity of the hypothalamo-pituitary adrenal axis permanently, but also changes activity of the second limb of the stress axis, the autonomic nervous system.
Apart from this general mechanism, we do not have a detailed understanding of how the stress axis in later life is altered after prenatal stress. For example, following prenatal stress exposure, human and animal studies show that the HPA axis and the ANS are even less active during certain stages of life. Generally, effects of prenatal stress on stress sensitivity during later life seem to depend on poorly determined conditions such as stress sensitive periods during early life, the amount of stress, and the adversity of the stressor.
Effects of increased stress sensitivity
Hypothalamo-pituitary adrenal axis hyperactivity leads to increased stress sensitivity. Increased stress sensitivity contributes to biological ageing through both excessive catecholamine and glucocorticoid secretion and through glucocorticoid receptor resistance. The latter increases the production of pro-inflammatory cytokines, accentuating potential neuronal damage. There are hints that prenatal stress may not only affect brain ageing but also predispose to brain-related diseases. Data from Roseboom's group from the Dutch famine cohort suggest that the cognitive function may deteriorate faster in those subjects who were prenatally exposed to the famine.
Van den Bergh's group is the only group who has tested whether the hypothalamo-pituitary adrenal axis mediates the link between prenatal maternal stress and offspring behavioral problems in humans. It was shown in the 15-year-old offspring that maternal anxiety during weeks 12 to 22 of pregnancy is associated with a high flattened diurnal cortisol profile that shows elevated cortisol secretion in the evening.
Moreover, the interaction of increased stress sensitivity and the serotonergic system may explain the occurrence of depressive disorders since cortisol inhibits this amine system. Indeed, van den Bergh's group has shown an effect of prenatal anxiety on depressed mood that, in part, can be due to a flattened cortisol profile. Depression can impact on the objective age-related cognitive impairment.
Changes in the trajectory of brain development
Maternal stress, glucocorticoid treatment and nutrient restriction during pregnancy may also change the trajectory of fetal brain development. Nathanielsz's and Schwab's groups have shown that prenatal glucocorticoid treatment at the clinical dose used to enhance fetal lung maturation affects neurogenesis and myelination in fetal sheep. Studies in rodents clearly show that nutrient restriction alters brain development and cognitive function in later life. Nathanielsz's and Schwab's groups have shown that even moderate maternal undernutrition affects neurogenesis and development of neuronal network formation in the fetal non-human primate. Similarly, abnormalities in brain structure were found in schizophrenic patients exposed to the Dutch famine winter.
While early intervention is desirable (prevention of stress in the womb), it is also necessary to identify treatment strategies for those individuals who have an increased risk for early brain ageing and age-associated brain disease. Currently, there are millions of people in the EU and all over the world who are already struggling with the effects of prenatal stress on their health. This population also needs targeted interventions.

Bea van den Bergh´s group is involved in developmental neuroscience and biological developmental psychology. She is a pioneer in studying the developmental origins of behavior, adding to the efforts of researchers worldwide who are working on the developmental origins of health and disease. Study of the Developmental Origins of Behavior, Health and Diseases (DOBHaD) addresses timely and much needed research issues related to the interface between medical and behavioral sciences. Her DOBHaD research program focuses on physiological and psychological processes and their interplay; thus, contributing to the understanding of mechanisms underlying DOBHaD and enhancing care for infants, children and adolescents with a prenatally acquired vulnerability for behavioural problems, psychopathology or chronic medical conditions. More specific goals are:
Christian Gaser leads the group on Structural Brain Mapping at the Dept. of Neurology. He has substantial experience to plan, perform, and lead independent and internationally distributed research projects. This is particularly documented by the achievements of his Independent Junior Research Group ”Neuroimaging” which has contributed to scientific progress in a wide range of topics in neuroscience, often working across field boundaries. His research group is supported by the Federal Ministry of Education and Research (BMBF) to develop and apply methods for patient classification using computational morphometry. He has carried out a great amount of work in the field of neuroimaging with a specific focus on the development of valuable analysis methods for structural brain data. Amongst these methods, he has developed and implemented the VBM (voxel-based morphometry) toolboxes as an extension to the algorithms used by SPM8 (Wellcome Department of Cognitive Neurology), the software package that is the central processing software for MR morphometry of this project. In addition, he has pioneered the analysis of use-dependent plasticity. Furthermore, he uses state-of-the-art techniques to assess the stage of age progression by estimating the individual BrainAGE scores with applications for the early detection of Alzheimer’s disease.
Biocrates is a leading biotech company in the field of metabolic biomarker research and kit development. Using a targeted, mass spectrometry-based metabolomics approach, Biocrates identifies and quantifies endogenous metabolites in body fluid or tissue samples and develops them into powerful biomarkers. Biocrates has a strong background in biological sciences and (bio-) informatics as well as long-standing experience in analytical method development, method application, data analysis, and project management. Biocrates is well equipped with a state-of-the-art mass spectrometry platform that, in combination with its comprehensive methodological knowledge, allows the accurate quantification of a vast range of metabolites across several biochemical classes in a targeted metabolomics approach. Biocrates has been involved in various international and national research consortia and by applying its analytical services, directly contributed to neonatal research projects like e.g. the EU-funded NEOBRAIN project.
Dr. Peter Nathanielsz, formerly director of the Center for Pregnancy and Newborn Research at the University of Texas Health Sciences Center, is now the Distinguished Research Professor of Life Course Studies within the UW College of Agriculture and Natural Resources´ Department of Animal Science.
Peter W. Nathanielsz has researched fetal development for over forty years and was recently named as one of the top 5% of funded NIH investigators in the United States. For his work on fetal development he has been made a Fellow ad Eundem of the Royal College of Obstetricians in England. He delivered the 2011 Messenger Lectures at Cornell University, that university’s highest scientific recognition. He wrote the first book for the general reader on Developmental Programming entitled Life in the Womb: The origin of health and disease, published in 1999.
The group is the only one in the world owning adult non-human primate cohorts that were prospectively exposed to different prenatal stressors (glucocorticoid exposure and nutrient restriction) and are dedicated to study Developmental Programming of Health and Disease in later life.
His mission is to understand the molecular mechanisms that underlie the ageing process and that lead to age-related diseases with the hope that eventually this knowledge can contribute to a more healthy ageing of the human population. Cooperating with clinical partners, the group is involved in detection and functional analyses of genetic & epigenetic variations that determine the individual susceptibility to complex disorders (inflammation, obesity, cancer) and ageing. They are also engaged in the sequence analysis of eukaryotic model organisms, prokaryotic genomes and metagenomes. The group is one of the first laboratories in Germany applying next-generation sequencing for genome and transcriptome analysis.
Dr. Juan Camilo Estrada received his Bachelor in Biochemistry from the Autonomous University of Madrid. He earned his Ph.D. in Molecular Biology at the prestigious National Center for Cardiovascular Diseases (CNIC). During his Ph.D. program he focused in the study of oxidative stress on genetic stability and biosafety of human stem cells for his therapeutic application. After his doctorate, he specialized in the study of non-canonical activity of telomerase in the cell metabolism and senescence. His works has allowed him to participate in various international conferences and publish several scientific articles in the arena of regenerative medicine and ageing, and develop a patent to identifying new genetic and transcriptional biomarkers of cellular senescence in culture. Dr. Estrada has extensive experience in the field of human molecular cytogenetic with strong handling of different probes (PNA, CEP and LSI) for the chromosome labeling by classic fluorescence in situ hybridization (FISH) and derived techniques as multicolor FISH (M-FISH) and quantitative FISH (Q-FISH).
The AMC is one of the most prominent medical centers in the Netherlands with a leading position in medical research, both nationally and internationally. Tessa Roseboom is one of the AMC´s Principal Investigators leading the Fetal Origins Research group within the Academic Medical Center. She obtained funding from the Dutch Heart Foundation, the Netherlands Organisation for Scientific Resaerch, The European Science Foundation (Eurostress Program), Medical Resaerch Courncil and the Diabetes Fund with a volume of nearly 1 million Euros. She established the healthy WOMB study center to investigate the role of various influences during early human development on later health.
She has long standing experience in studying the early origins of later disease. She has worked on the Dutch famine birth cohort study for the past 15 years, and has led that study during the past 10 years. This cohort consists of 2.414 singletons who were born around the time of the Dutch famine in 1944-45. The cohort has been followed up extensively, focussing not only on metabolic and cardiovascular disease, but also on psychiatric diseases, infections, wellbeing, and certain types of cancer. She was the first to demonstrate that undernutrition during gestation in humans is associated with a doubled rate of heart disease, and of late, she also found suggestions of earlier brain ageing. She has been involved in investigateing research into gene environmental interactions, transgenerational effects, and outcome on reproductive succcess and epigenetic mechanisms.
Matthias Schwab is a trained pathophysiologist and neurologist. He is a senior member of the Department of Neurology and Head of the Research Group 'Fetal Brain Development and Programming of Diseases in Later Life' for more than 15y and strongly committed to the link between human development and ageing. His focus is on fetal brain development and the programming of brain-related disorders with a strong emphasis on stress effects and inflammation. He represents one of the first scientist who dealt with effects of prenatal glucocorticoid exposure on the brain using large animal models. He has a long-standing and successful cooperation with many partners in Europe and worldwide which have resulted in many joint publications. Prof. Schwab is head of the interdisciplinary sleep research unit with focus on autonomous and vascular dysregulation during prenatal development of sleep and during ageing. He has developed innovative nonlinear methods of EEG analysis.
Jan Tuckermann and his group’s aim is the deeper understanding of the action of GCs via their nuclear receptor (GR) in age-related processes. They use a combinatorial approach employing functional characterization of mouse strains conditionally mutated both in the GR and selected target genes in disease models, together with the development of functional screening tools for relevant cell types in age-related disorders. Here the goal is to decipher new mechanisms and to identify new mediators of therapeutic and side effects of GCs. Thus, by understanding GC-mediated effects in organs and tissues, knowledge about about degenerative processes during ageing can be acquired.










coming soon
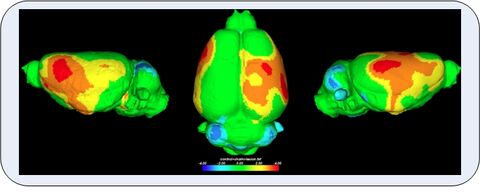

Hermes M, Antonow-Schlorke I, Hollstein D, Kühn S, Rakers F, Frauendorf V, Dreiling M, Rupprecht S, Schubert H, Witte OW, Schwab M (2020). Maternal psychosocial stress during early gestation impairs fetal structural brain development in sheep. Stress 23(2):233-242.
Schwab M, Witte OW. Prenatal stress and brain disorders in later life. (2020). Neurosci Biobehav Rev. 2020 Jun 16:S0149-7634(20)30429-2. doi: 10.1016/j.neubiorev.2020.06.002.
Franke K, Bublak P, Hoyer D, Billiet T, Gaser C, Witte OW, Schwab, M (2020). In vivo biomarkers of structural and functional brain development and ageing. Neurosci Biobehav Rev in press.
Franke K, Van den Bergh BRH, Rakers F, Kroegel N, de Rooij SR, Roseboom TJ, Witte OW, Nathanielsz, PW Schwab, M (2020). Effects of Malnutrition and Maternal Stress during Pregnancy on Offspring Brain Structure in Humans. Neurosci Biobehav Rev 2020 Jan 28:S0149-7634(17)30748-0. doi: 10.1016/j.neubiorev.2020.01.031.
Müller JJ, Antonow-Schlorke I, Kroegel N, Rupprecht S, Rakers F, Witte OW, Schwab M (2018). Cardiovascular effects of prenatal stress – Are there implications for cerebrovascular, cognitive and mental health outcome? Neurosci Biobehav Rev in press.
Van den Bergh B.R.H., van den Heuvel MI., Lahti M., Braeken M., de Rooij S.R., Entringer S., Hoyer D., Roseboom T., Räikkönen K., King S., Schwab M. (2018). Prenatal developmental origins of behavior and mental health: The influence of maternal stress in pregnancy. Neurosci Biobehav Rev Jul 28. pii: S0149-7634(16)30734-5. [Epub ahead of print].
Rakers F, Rupprecht S, Dreiling M, Bergmeier C, Witte OW, Schwab M (2017). Transfer of maternal psychosocial stress to the fetus. Neurosci Biobehav Rev doi: 10.1016/j.neubiorev.2017.02.019. [Epub ahead of print].
Sahm A, Bens M, Henning Y, Vole C, Groth M, Schwab M, Platzer M, Szafranski K, Dammann P (2018). Higher transcriptome 1 stability during 2 aging in long-lived giant mole-rats 3 compared to short-lived rats. Aging-US 10(12):3938-56.
Schiffner R, Bischoff S, Schubert H, Rakers F, Rupprecht S, Maziolis G, Huber O, Lemke C, Rupprecht S (2018). Schwab M, Lehmann T, Schmidt M. Underlying mechanism of subcortical brain protection during hypoxia and reoxygenation in a sheep model - influence of α1-adrenergic signaling. PLoS one 13(5):e0196363.
Sahm A, Bens M, Szafranski K, Holtze S, Groth M, Görlach M, Calkhoven C, Müller C, Kaether C, Schwab M, Cellerino A, Hildebrandt T, Burda H, Dammann P, Platzer M. (2018). Long-lived rodents reveal signatures of positive selection in genes associated with lifespan and eusociality. PLoS Genet 14(3):e1007272.
Dreiling M, Schiffner R, Bischoff S, Rupprecht S, Kroegel N, Schubert H, Witte OW, Schwab M, Rakers F (2018). Impact of chronic maternal stress during early gestation on maternal-fetal stress transfer and fetal stress sensitivity in sheep. Stress 21 (1):1-10.
Franke K, Gaser C, Roseboom TJ, Schwab M, de Rooij SR (2017). Premature brain aging in humans exposed to maternal nutrient restriction during early gestation. Neuroimage 173:460-71.
Franke K, Clarke GD, Dahnke R, Gaser C, Kuo AH, Li C, Schwab M, Nathanielsz PW (2017). Premature brain aging in baboons resulting from moderate fetal undernutrition. Front Aging Neurosci 9:92.
Agba OB, Lausser L, Huse K, Bergmeier C, Jahn N, Groth M, Bens M, Gall M, Witte OW, Kestler H, Schwab M, Platzer M (2017). Tissue-, sex- and age-specific DNA methylation of rat glucocorticoid receptor gene promoter and insulin like growth factor 2 imprinting control region. Physiol Genomics 49(11):690-702.
Kuo AH, Li C, Huber HF, Schwab M, Nathanielsz PW, Clarke GD (2017). Maternal nutrient restriction during pregnancy and lactation leads to impaired right ventricular function in young adult baboons. J Physiol 595(13):4245-4260.
Kuo AH, Li J, Li C, Huber H, Schwab M, Nathanielsz PW, Clarke G (2017). Prenatal steroid administration leads to adult pericardial and hepatic steatosis in male baboons. Int J Obesity (Lond). 2017 Aug;41(8):1299-1302.
Müller JJ, Schwab M Rosenfeld CR, Antonow-Schlorke I, Nathanielsz PW, Rakers F, Schubert, H, Witte OW, Rupprecht S (2017). Fetal sheep mesenteric resistance arteries in sheep: functional and structural maturation. J Vasc Res 54(5):259-271.
Schiffner R, Rodríguez-González GL, Rakers F, Nistor M, Nathanielsz PW, Daneva T, Schwab M, Lehmann T, Schmidt M (2017). Effects of late gestational fetal exposure to dexamethasone administration on the postnatal hypothalamus-pituitary-adrenal axis response to hypoglycemia in pigs. Int J Mol Sci 18(11). pii: E2241.
Schiffner R., Bischoff S.J., Lehmann T., Rakers F., Rupprecht S., Reiche J., Matziolis G., Schubert H., Schwab M., Huber O., Schmidt M (2017). Redistribution of cerebral blood flow during severe hypovolemia and reperfusion in a sheep model: critical role of α1-adrenergic signaling. Int J Mol Sci 18(5). pii: E1031.
Anegroaie P, Frasch MG, Rupprecht S, Antonow-Schlorke I, Müller T, Schubert H, Witte OW, Schwab M (2017). Development of somatosensory-evoked potentials in foetal sheep: effects of betamethasone. Acta Physiol (Oxf) 220(1):137-49.
Bischoff SJ, Schmidt M, Lehmann T, Irintchev A, Schubert H, Jung C, Schwab M, Huber O, Matziolis G, Schiffner R (2016). Increase of cortical cerebral blood flow and further cerebral microcirculatory effects of Serelaxin in a sheep model. Am J Physiol Heart Circ Physiol 311(3):H613-20.
de Rooij SR, Caan MW, Swaab DF, Nederveen AJ, Majoie CB, Schwab M, Painter RC, Roseboom TJ (2016). Prenatal famine exposure has sex-specific effects on brain size. Brain 139(Pt 8):2136-42.
Dreiling M, Bischoff S, Schiffner R, Rupprecht S, Kiehntopf M, Schubert H, Witte OW, Nathanielsz PW, Schwab M, Rakers F (2016). Stress-induced decrease of uterine blood flow in sheep is mediated by alpha 1-adrenergic receptors. Stress 19 (5):547-51.
Rakers, F, Schiffner, R, Brandstädt, A, Rupprecht, S, Witte, OW, Schlattmann, P, Schwab, M (2016). Rapid weather changes are associated with increased ischemic stroke risk: a case-crossover study. Eur J Epidemiol 31(2), 137-146.
Bischoff SJ, Schmidt M, Lehmann T, Schwab M, Matziolis G, Saemann A, Schiffner R (2015). Renal glucose release during hypoglycemia is partly controlled by sympathetic nerves - a study in pigs with unilateral surgically denervated kidneys. Physiol Rep 3(11):pii: e12603.
de Rooij, SR, van Pelt AAM, Ozanne SE, Korver CM, van Daalen SK, Painter RC, Schwab M, Viegas MH:, Roseboom TJ (2015). Prenatal undernutrition and leukocyte telomere length in late adulthood: the Dutch famine birth cohort study. Am J Clin Nutr 102(3):655-60.
Rakers F, Bischoff S, Schiffner, R, Haase M, Rupprecht S Kiehntopf M, Kühn-Velten WN, Schubert H, Witte OW, Nijland MJ, Nathanielsz PW, Schwab, M (2015). Role of Catecholamines in Maternal-Fetal Stress Transfer in Sheep Fetus. Am J Obstet Gynecol 213(5):684.e1-9.
Xie L, Antonow-Schlorke I, Schwab M, McDonald, TJ, Nathanielsz PW (2013). The frontal cortex IGF system is down regulated in the term, intrauterine growth restricted fetal baboon. Growth Horm IGF Res 23(5):187-92.
Rakers F, Frauendorf V, Rupprecht S, Schiffner R, Bischoff S, Kientopf, M, Reinhold P, Witte OW, Schubert H, Schwab, M (2013). Effects of early and late-gestational maternal stress and synthetic glucocorticoids on development of the fetal hypothalamic–pituitary–adrenal axis in sheep. Stress 16:122-9.
Schwab M, Coksaygan T, Rakers F, Nathanielsz PW (2012). Glucocorticoid exposure of sheep at 0.7 to 0.75 gestation augments late gestation fetal stress responses. Am J Obstet Gynecol 206(3):253.e16-22.
Antonow-Schlorke I1, Schwab M1, Cox LA, Li C, Stuchlik K, Witte OW, Nathanielsz PW, McDonald TJ (2011). Vulnerability of the fetal primate brain to moderate reduction in maternal global nutrient availability. PNAS 108(7):3011-6 (1authors contributed equally to the paper).
Schneider U, Arnscheidt C, Schwab M, Haueisen J, Seewald, HJ Schleussner, E (2010). Steroids that induce lung maturation acutely affect higher cortical function: a fetal magnetoencephalography study. Reprod Sci 18(1):99-106
Löhle M, Schwab M, Kadner S, Ford S, Nijland M, Lawrence P, Gilbert J, Brenna T, Nathanielsz PW (2009). Dose response effects of betamethasone on maturation of the fetal sheep fetal lung. Am J Obstet Gynecol 202(2):186.e1-7.
Frasch MG, Müller T, Szynkaruk M, Schwab M (2009). Validation of spontaneous assessment of baroreceptor reflex sensitivity and its relation to heart rate variability in the ovine fetus pre- and near-term. Can J Physiol Pharmacol l87(9):736-42.
Schwab K, Groh T, Schwab M, Witte H (2009). Nonlinear analysis and modeling of cortical activation and deactivation patterns in the immature fetal electrocorticogram. Chaos 19(1):015111.
Frasch MG, Müller T, Hoyer D, Weiss C, W Schubert H, Schwab M (2009). Nonlinear properties of vagal and sympathetic modulations of heart rate variability in ovine fetus near term. Am J Physiol 296(3):R702-7.
Frasch MG, Müller T, Wicher C, Weiss C, W Schwab K, Schubert H, Schwab M (2009). Heart rate variability analysis allows early asphyxia detection in ovine fetus. Reprod Sci 16(5):509-17.
Antonow-Schlorke I, Helgert A, Gey C, Coksaygen T, Schubert H, Nathanielsz PW, Witte OW, Schwab M (2009). Adverse effects of antenatal glucocorticoids on cerebral myelination in sheep are dose dependent and specific to the fetal stage of development. Obstet Gynecol 113(1):142-151.
Raschke C, Schmidt S, Schwab M, Jirikowski G (2008). Effects of betamethasone treatment on central myelination in fetal sheep: an electron microscopical study. Anat Histol Embryol 37:95-100.
McCallum J, Smith N, Schwab M, Nathanielsz PW, Coksaygan T, Reinhardt B, Richardson B (2008). Effects of antenatal glucocorticoids on cerebral substrate metabolism in the pre-term ovine fetus. Am J Obstet Gynecol 198:105.e1-9.
McCallum J, Smith N, MacLachlan JN, Coksaygan T, Schwab M, Nathanielsz PW, Richardson B (2008). Effects of antenatal glucocorticoids on cerebral protein synthesis in the pre-term ovine fetus. Am J Obstet Gynecol 198:103.e1-6.
Antonow-Schlorke I, Müller T, Brodhun M, Wicher C, Schubert H, Nathanielsz PW, Witte OW, Schwab M (2007). Betamethasone related acute alterations of microtubule associated proteins in the fetal sheep brain are reversible and independent of age during the last third of gestation. Am J Obstet Gynecol 196:553.e1-6. (“Editors choice”)
Frasch MG, Müller T, Wicher C, Weiss C, W Löhle M, Schwab K, Schubert H, Nathanielsz, PW, Witte OW, Schwab M (2007). Fetal body weight and the development of the control of the cardiovascular system in fetal sheep. J Physiol (Lond) 579:893-907
Antonow-Schlorke I, Ebert M, Cun L, Gschanes A, Witte OW, Nathanielsz PW, Schwab M (2007). Effects of antenatal glucocorticoid therapy on glucose transporter proteins in the fetal baboon brain. J Med Primatol 36:17-20.
Frank B, Frasch MG, Schneider U, Roedel M, Schwab M, Hoyer D. (2006) Complexity of heart rate fluctuations in near-term sheep and human fetuses during sleep. Biomed Tech (Berl). 51:233-6.
Schwab M, Coksaygan T, Samtani M, Jusko WJ, Nathanielsz PW (2006). Kinetics of betamethasone and fetal cardiovascular adverse effects in pregnant sheep after different doses. Obstet Gynecol 108:617-25.
Antonow-Schlorke I, Ebert M, Müller T, Coksaygan T, Schubert H, Gschanes A, Witte OW, Nathanielsz PW, Schwab M (2006). Glucocorticoid effects on glucose transporter proteins in the fetal sheep brain. Neurosci Lett 403(3):261-265.
Schwab M, Coksaygan T, Nathanielsz PW (2006). Betamethasone effects on ovine uterine and umbilical placental perfusion at the dose used to enhance fetal lung maturation. Am J Obstet Gynecol 194:572-579.
Löhle M, Müller T, Wicher C, Roedel M, Schubert H, Nathanielsz PW, Witte OW, Schwab M (2005). Betamethasone effects on fetal sheep cerebral blood flow are not dependent on maturation of cerebrovascular system and pituitary-adrenal axis. J Physiol (Lond) 564:575-588.
Samtani MN, Schwab M, Nathanielsz PW, Jusko WJ (2004). Area/moment and compartmental modeling of pharmacokinetics during pregnancy: applications to maternal/fetal exposures to corticosteroids in sheep and rats. Pharm Res 21:2279-2292.
Colberg C, Antonow-Schlorke I, Müller T, Schubert H, Nathanielsz PW, Witte OW, Schwab M (2004). Recovery of glucocorticoid-related loss of synaptic density in the fetal sheep brain at 0.75 of gestation. Neurosci Lett 364:130-134.
Samtani MN, Schwab M, Nathanielsz PW, Jusko WJ (2004). Stabilization and HPLC analysis of betamethasone sodium phosphate in plasma. J Pharm Sci 93: 726-732.
Antonow-Schlorke I, Schwab M, Li C, Nathanielsz PW (2003). Glucocorticoid exposure at the dose used clinically alters cytoskeletal proteins and presynaptic terminals in the fetal baboon brain. J Physiol (Lond) 547: 117-123. (Artikel erhielt Titelblatt des Journals).
Müller T, Schubert H, Schwab M (2003). Early prediction of fetal numbers in sheep based on peripheral plasma progesterone concentrations and season of the year. Vet Rec 152:137-8.
Müller T, Löhle M, Schubert H, Wicher C, Antonow-Schlorke I, Sliwka U, Nathanielsz PW, Schwab M (2002). Developmental changes in cerebral autoregulatory capacity in the fetal sheep parietal cortex. J Physiol (Lond) 539: 957-67.
Schwab M, Rödel M, Schmidt K, Müller T, Schubert H, Anwar M A, Nathanielsz PW (2001). Nonlinear changes of electrocortical activity after antenatal betamethasone treatment in fetal sheep. J Physiol (Lond) 531: 535-543.
Schwab M, Antonow-Schlorke I, Kühn B, Müller T, Schubert H, Walter B, Sliwka U, Nathanielsz PW (2001). Effect of antenatal betamethasone treatment on microtubule associated proteins MAP1B and MAP2 in fetal sheep. J Physiol (Lond) 530: 497-506. (Artikel erhielt Titelblatt des Journals).
Antonow-Schlorke I, Kühn B, Müller T, Schubert H, Sliwka U, Nathanielsz P W, Schwab M (2001). Antenatal betamethasone treatment reduces synaptophysin in presynaptic terminals in the fetal sheep brain. Neurosci Lett 297: 147-150.
Schwab M, Rödel M, Anwar M A, Buchwalder LF, Müller T, Schubert H, Walter B, Nathanielsz PW (2000). Effects of betamethasone administration to the fetal sheep in late gestation on fetal cerebral blood flow. J Physiol (Lond) 528: 619-632.
Schmidt K, Kott M, Müller T, Schubert H, Schwab M (2000). Developmental changes in the complexity of the electrocortical activity in fetal sheep. J Physiol (Paris) 94: 435-443.
Schwab M, Schmidt K, Witte H, Abrams RM (2000). Investigation of nonlinear ECoG changes during spontaneous sleep state changes and cortical arousal in fetal sheep. Cereb Cortex 10: 142-148.
Schmidt K, Schwab M, Abrams RM, Witte H (1999). Nonlinear analysis of the fetal ECoG: predictability and bispectral measures. Theor Biosci 118: 219-230.
Witte H, Breidbach O, Schmidt K, Schwab M (1999). News and views in signal analysis of the electröncephalogram (EEG). Theor Biosci 118: 284-299.
Anwar MA, Schwab M, Poston L, Nathanielsz PW (1999). Betamethasone mediated vascular dysfunction and changes in hematological profile in the ovine fetus. Am J Physiol 276: H1137-1143.
Schwab M, Antonow-Schlorke I, Zwiener U, Bauer R (1998). Brain derived peptides reduce the size of cerebral infarction and loss of MAP2 after focal ischemia in rats. J Neural Transmiss Suppl. 53: 299-311.
Antonelli P, Abrams RM, Gerhardt KJ, Schwab M, Bauer R (1998). Vestibular function of the fetal sheep. Otolaryngol Head Neck Surg 118: 571-575.
Abrams RM, Schwab M, Gerhardt KJ, Bauer R, Antonelli P (1998). Caloric stimulation of the inner ear in fetal sheep: Effect on eye movements and electrocorticogram. Int J Ped Otorhinolaryngol 45: 59-68.
Schwab M, Bauer R, Zwiener U (1998). Mild hypothermia prevents the occurrence of cytotoxic brain edema in rats. Acta Neurobiol Exp 58: 29-35.
Schwab M, Bauer R, Zwiener U (1997). The distribution of normal brain water content in wistar rats and its increase due to ischemia. Brain Res 749: 82-87.
Schwab M, Schaller R, Bauer R, Zwiener U (1997). Morphofunctional effects of permanent bilateral carotid occlusion and short-term hypoxia in rats. Exp Tox Pathol 49: 29-37.
Schwab M, Bauer R, Zwiener U (1997). Physiological effects and brain protection by hypothermia and Cerebrolysin after permanent bilateral carotid artery clamping in rats. Exp Tox Pathol 49: 105-116.
Bauer R, Schwab M, Abrams RM, Stein J, Gerhardt KJ (1997). Electrocortical and heart rate response during vibroacoustic stimulation in fetal sheep. Am J Obstet Gynecol 177: 66-71.
Schwab M, Antonow-Schlorke I, Dürer U, Bauer R (1996). Effects of Cerebrolysin on cytoskeletal proteins after focal ischemia in rats. J Neural Transmission Suppl 47: 279.
Abrams RM, Schwab M, Gerhardt KJ, Bauer R, Peters AJM (1996). Vibroacoustic stimulation with a complex signal: Effect on behavioral state in fetal sheep. Biol Neonate 70: 155-164
Bis in die 1960-er Jahre galt das Dogma, daß das erwachsene Gehirn keine neuen Neurone bilden kann. Seither weiß man, daß im Gehirn zwei Regionen existieren, in die zeitlebens neue Neurone integriert werden: der Bulbus olfactorius und der Gyrus dentatus des Hippocampus. Während ihrer Reifung besitzen die neugeborenen Neurone des Gyrus dentatus besondere physiologische Eigenschaften, die sie leicht erregbar und besonders plastisch machen. Gemeinsam mit verhaltensbiologischen Befunden deutet dies darauf hin, daß sie in besonderer Weise zu Funktionen des Hippocampus, wie dem Speichern und Abrufen von Gedächtnisinhalten, beitragen. Störungen adulter Neurogenese werden zunehmend mit neurologischen Erkrankungen und kognitiven Beeinträchtigungen im Alter in Verbindung gebracht.
Der adulte Gyrus dentatus beherbergt eine kleine Population multipotenter Stammzellen, aus denen über verschiedene Vorläuferstaden zeitlebens neue Nervenzellen gebildet werden (adulte Neurogenese). Dieser Stammzellpool wird während der frühen Postnatalentwicklung angelegt und nimmt mit zunehmendem Alter ab - eine wichtige Ursache für die sinkende Neurogenese während der Alterung. Wann und wie der adulte Stammzellpool gebildet wird, wo der ontogenetische Usprung dieser Zellen liegt und warum und wie die adulte Stammzellnische altert, ist immernoch unklar.
Als Schnittstelle zwischen Extrazellulärmillieu und Zellzyklusmaschinerie spielen D-Cycline eine Schlüsselrolle für das Voranschreiten des Zellzyklus (Progression der G1-Phase und G1/S-Phase-Übergang). Unsere bisherigen Untersuchungen zeigen, daß insbesondere Cyclin D2 wichtige Funktionen für die lebenslange Neurogenese im adulten Gyrus dentatus erfüllt. Welche Rolle D-Cycline für die Proliferation, Differenzierung und das Schicksal adulter Stamm- und Vorläuferzellen im Gyrus dentatus haben, ist unbekannt. Dies und die Funktion von D-Cyclinen während der Entwicklung des Gyrus dentatus und des adulten Stammzellpools ist Gegenstand laufender Untersuchungen.
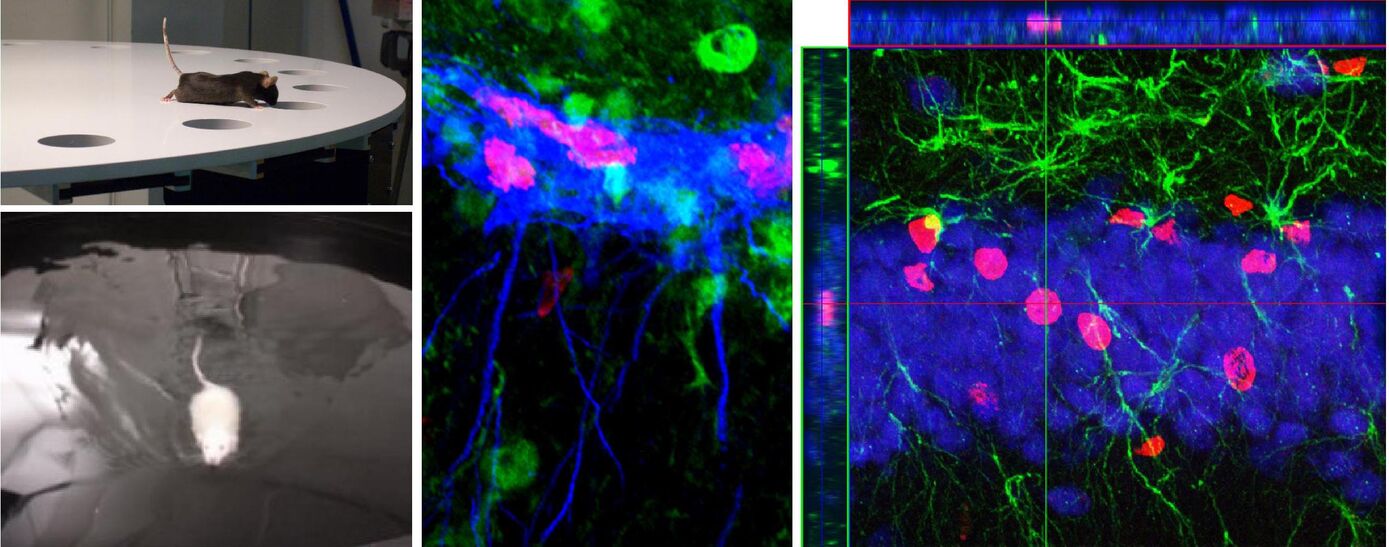
Die neugeborenen Neurone im adulten Gyrus dentatus werden innerhalb weniger Wochen vollständig ins hippocampale Netzwerk integriert. Inwiefern diese besondere Form struktureller Plastizität die Informationsverarbeitung im Hippocampus beeinflusst, kann heute nicht zweifelsfrei beantwortet werden. Bisherige Untersuchungen deuten darauf hin, daß die neu geborenen Nervenzellen eine wichtige Rolle bei der räumlichen Orientierung und der Mustererkennung („pattern separation“) spielen. Es wird vermutet, daß sie zur Aufrechterhaltung kognitiver Flexibiliät, also der Integration neuer Gedächtnisinhalte mit bereits bestehende und ohne Zerstörung dieser, beitragen. Zur Klärung dieser Frage nutzen wir verschiedene Mausmodelle, mit deren Hilfe die hippocampale Neurogenese in unterschiedlicher Weise manipuliert werden kann. Mit Hilfe verhaltensbiologischer Tests untersuchen wir, ob sich Änderungen der Neurogeneserate in veränderten Lern- und Gedächtnisleistungen manifestieren, immunhistochemische und molekularbiologische Methoden werden genutzt, um die Integration der neugebildeten Nervenzellen in hippocampale Schaltkreise für z.B. räumliches Lernen und Gedächtnis zu analysieren.
Das Phänomen der kortikalen Streudepolarisation (CSD) wurde erstmals vor etwa 70 Jahren durch den Brasilianischen Physiologen Aristides P. Leao beschrieben. Seither wurde es in verschiedenen Spezies wie Nagetieren und Primaten nachgewiesen. Während einer CSD kommt es zur Deploarisation von Neuronen und Gliazellen, welche sich wellenförmig vom Auslöseort über die ipsilaterale graue Substanz ausbreitet. Durch die massiven Ionenverschiebungen kommt es zur einer vorübergehenden Depression der spontanen Hirnaktivität ("spreading depression"), parallel kommt es zu metabolischen und hämodynamischen Reaktionen. In der jüngeren Vergangenheit konnten CSD auch beim Menschen nachgewiesen werden. So treten sie bei ischämischen und hämorrhagischen Hirninfarkten, traumatischen Hirnverletzungen und Migräne auf. Wie neueste experimentelle und klinische Studien zeigen, führen CSD im Kontext dieser Pathologien häufig zu zusätzlichem Zelluntergang (z.B. Infarktprogression in die hypoxische Penumbra hinein nach ischämischen Schlaganfall; Auslöser verzögerter ischämischer Schlaganfälle nach Subarachnoidalblutung) und neurologischen Defiziten. Demgegenüber sind CSD im gesunden Hirn reversibel und ziehen keinerlei Schädigung des Hirnparenchyms nach sich. Vielmehr induzieren sie hier Toleranz gegenüber ischämischen Schädigungen und erhöhen die Plastizität sowohl in direkt betroffenen und entfernten Hirnarealen (z.B. Heraufregulation von Plastizitätsmarkern und Bildung neuer Gliazellen im Kortex, Steigerung hippocampaler Neurogenese). Derzeit widmen wir uns der Frage, wie genau CSD den Prozess der adulten Neurogenese beeinflußt und welche verhaltensbiologischen Konsequenzen daraus resultieren. Dies hilft uns zu verstehen, wie CSD zur Pathogenese der Migräne beiträgt oder inwieweit sie Reorganisationsprozesse nach malignen Hirnschädigungen fördern kann.
Pensold D, Reichard J, Van Loo KMJ, Ciganok N, Hahn A, Bayer C, Liebmann L, Groß J, Tittelmeier J, Lingner T, Salinas-Riester G, Symmank J, Halfmann C, González-Bermúdez L, Urbach A, Gehrmann J, Costa I, Pieler T, Hübner CA, Vatter H, Kampa B, Becker AJ, Zimmer-Bensch G: DNA Methylation-Mediated Modulation of Endocytosis as Potential Mechanism for Synaptic Function Regulation in Murine Inhibitory Cortical Interneurons. Cerebral Cortex, 2020; https://doi.org/10.1093/cercor/bhaa009
Trautmann C, Bock A, Urbach A, Hübner CA, Engmann O: Acute vitamin B12 supplementation evokes antidepressant response and alters Ntrk-2. Neuropharmacology, 2020. https://doi.org/10.1016/j.neuropharm.2020.108112
Hahn A, Bayer C, Pensold D, Tittelmeier J, Marx-Bluemel L, Gonzalez-Bermudez L, Linde J, Gross J, Salinas-Riester G, von Maltzahn J, Spehr M, Pieler T, Urbach A, Zimmer-Bensch G: DNA methyltransferase 1 (DNMT1) function is implicated in the age-related loss of cortical interneurons. Front Cell Dev Biol, 2020; https://doi.org/10.3389/fcell.2020.00639
Grünewald G, Wickel J, Hahn N, Hörhold F, Rupp H, Chung HY, Haselmann H, Strauss AS, Schmidl L, Hempel N, Grünewald L, Urbach A, Bauer M, Toyka KV, Blaess M, Claus RA, König R, Geis C: Targeted rescue of synaptic plasticity improves cognitive decline after severe systemic inflammation. bioRxiv 2021. https://doi.org/10.1101/2021.03.04.433352
IZKF Advanced Medical Scientist program, 2019-2022
Wir suchen kontinuierlich motivierte Bachelor- und Masterstudenten sowie Doktoranden, die uns in unseren Forschungsprojekten unterstützen.
Die Arbeitsgruppe Neurodegenerative Erkrankungen NEDIG bildet im Thüringer Muskelzentrum mit der Spezialambulanz für neuromuskuläre und Motoneuronerkrankungen und dem Studienbereich Neuromuskuläre und Motoneuron-Erkrankungen eine translationale Forschungseinheit. Im Zentrum unserer Forschungsansätze steht die Amyotrophe Lateralsklerose, die pars pro toto eine Reihe von Aspekten von Neuromuskulären und von Neurodegenerativen Erkrankungen abbildet.


motor neuron disease association
EU Joint Programming for Neurodegenerative Disease Research (JPND)
Deutsche Forschungsgemeinschaft DFG
Die Publikationen der Arbeitsgruppe NEDIG finden Sie unter Pubmed.com, ResearchGate und Scholar.



Unsere Arbeitsgruppe hat das Ziel die Mechanismen der altersbedingten Abnahme neuraler Stammzellen und neugebildeter Nervenzellen zu erforschen. Dabei fokussiert sich die Arbeitsgruppe auf das Teilungsverhalten, die proliferative Kapazität und das Differenzierungspotential der Stammzellen während der Alterung unter physiologischen und pathophysiologischen Bedingungen. Wir konzentrieren uns dabei auf zwei Regionen des Gehirns in dem zeitlebens Neurogenese durch neurale Stammzellen stattfindet: der Gyrus dentatus der Hippokampusformation und die subventrikulär Zone der lateralen Ventrikel/Riechhirn.
Unsere Schlüsselfragen sind unter anderem:
• Warum nehmen der Stammzellpool und die Neurogenese während der Alterung massiv ab?
• Wie verändert sich die Selbsterneuerung der Stammzellen während der Alterung?
• Wie verändert sich das Differenzierungspotential der Stammzellen während der Alterung?
• Welche zellulären Mechanismen liegen der altersbedingten Abnahme des Stammzellpools zugrunde?
• Wie verändern sich die Hippokampus-abhängigen Lern- und Gedächnisvorgänge während der Alterung?
Zur Beantwortung unserer Fragen bedienen wir uns neusten Techniken wie beispielsweise transgene induzierbare Mausmodelle, in vivo clonal analysis, lineage tracing und fate mapping Experimente, viraler Gentransfer, CLARITY Methode, immunhistochemischer- und molekularbiologischer Verfahren, eine Auswahl von kognitiven und motorischen Verhaltenstests, Implantationen mini osmotischer Pumpen, konfokaler Mikroskopie, verschiedene Schlaganfallmodelle und unterschiedliche Aktivitätsparadigmen.
2024: Honours-Programm für forschungsorientierte Studierende (Leander Löber)
2024: Alzheimer Forschung Initiative e.V. (AFI) Travel Grant (Leander Löber)
2024: IZKF Travel Grant (Hanna Gude)
2021: Scholarship of the JSMM (Mahmoud Dahab Mohamed)
2021: IBRO International Travel Grants (Mahmoud Dahab Mohamed)
2005: Neurobiology Award of Excellence (NIH) bestowed upon by the Sam Schmidt Paralysis Foundation “Route 28 Summits in Neurology: Restoring Mobility: Stem Cells and Sensory/Motor Systems of the Spinal Cord”, Semiahmoo, Washington, USA
Aktuelle Förderungen
IZKF Promotionsstipendien (HG), 2024
Ausgelaufene Förderungen
Woitke F, Blank A, Fleischer AL, Zhang S, Lehmann GM, Broesske J, Haase M, Redecker C, Schmeer CW, Keiner S.
Post-Stroke Environmental Enrichment Improves Neurogenesis and Cognitive Function and Reduces the Generation of Aberrant Neurons in the Mouse Hippocampus. Cells. 2023 Feb 17;12(4):652. doi: 10.3390/cells12040652. PMID: 36831319
Rudolph M, Schmeer CW, Günther M, Woitke F, Kathner-Schaffert C, Karapetow L, Lindner J, Lehmann T, Jirikowski G, Witte OW, Redecker C, Keiner S. Microglia-mediated phagocytosis of apoptotic nuclei is impaired in the adult murine hippocampus after stroke. Glia. 2021 Aug;69(8):2006-2022. doi: 10.1002/glia.24009. Epub 2021 May 4. PMID: 33942391
Ceanga M, Dahab M, Witte OW, Keiner S. Adult Neurogenesis and Stroke: A Tale of Two Neurogenic Niches. Front Neurosci. 2021 Aug 10;15:700297. doi: 10.3389/fnins.2021.700297. eCollection 2021. PMID: 34447293 Free PMC article. Review.
Bluemel P, Wickel J, Grünewald B, Ceanga M, Keiner S, Witte OW, Redecker C, Geis C, Kunze A. Sepsis promotes gliogenesis and depletes the pool of radial glia like stem cells in the hippocampus. Exp Neurol. 2020 Dec 30:113591. doi: 10.1016/j.expneurol.2020.113591. Online ahead of print. PMID: 33387461
Weselek G, Keiner S, Fauser M, Wagenführ L, Müller J, Kaltschmidt B, Brandt MD, Gerlach M, Redecker C, Hermann A, Storch A. Norepinephrine is a negative regulator of the adult periventricular neural stem cell niche. Stem Cells. 2020 May 30. doi: 10.1002/stem.3232. Online ahead of print. PMID: 32473039
Kathner-Schaffert C, Karapetow L, Günther M, Rudolph M, Dahab M, Baum E, Lehmann T, Witte OW, Redecker C, Schmeer CW, Keiner S. Early Stroke Induces Long-Term Impairment of Adult Neurogenesis Accompanied by Hippocampal-Mediated Cognitive Decline. Cells. 2019 Dec 17;8(12):1654. doi: 10.3390/cells8121654.
Fiebig C, Keiner S, Ebert B, Schäffner I, Jagasia R, Chichung Lie D and Beckervordersandforth R. Mitochondrial Dysfunction in Astrocytes Impairs the Generation of Reactive Astrocytes and Enhances Neuronal Cell Death in the Cortex Upon Photothrombotic Lesion. Front Mol Neurosci. 2019 Feb 22;12:40.
Ceanga M, Keiner S, Grünewald B, Haselmann H, Frahm C, Couillard-Després S, Witte OW, Redecker C, Geis C, Kunze A. Stroke Accelerates and Uncouples Intrinsic and Synaptic Excitability Maturation of Mouse Hippocampal DCX+ Adult-Born Granule Cells. J Neurosci. 2019 Feb 27;39(9):1755-1766.
Tadić V, Adam A, Goldhammer N, Lautenschlaeger J, Oberstadt M, Malci A, Le TT, Sengupta S, Stubendorff B, Keiner S, Witte OW, Grosskreutz J. Investigation of mitochondrial calcium uniporter role in embryonic and adult motor neurons from G93AhSOD1 mice. Neurobiol Aging. 2019 Mar;75:209-222.
Sengupta S, Le TT, Adam A, Tadić V, Stubendorff B, Keiner S, Kloss L, Prell T, Witte OW, Grosskreutz J. Interferon-γ Receptor 1 and GluR1 upregulated in motor neurons of symptomatic hSOD1G93A mice. Eur J Neurosci. 2019 Jan;49(1):62-78.
Woitke F, Ceanga M, Rudolph M, Niv F, Witte OW, Redecker C, Kunze A, Keiner S. Adult hippocampal neurogenesis poststroke: More new granule cells but aberrant morphology and impaired spatial memory. PLoS One. 2017 Sep 14;12(9):e0183463.
Tadić V, Malci A, Goldhammer N, Stubendorff B, Sengupta S, Prell T, Keiner S, Liu J, Guenther M, Frahm C, Witte OW, Grosskreutz J. Sigma 1 receptor activation modifies intracellular calcium exchange in the G93AhSOD1 ALS model. Neuroscience. 2017 Sep 17;359:105-118.
Keiner S, Niv F, Neumann S, Steinbach T, Schmeer C, Hornung K, Schlenker Y, Förster M, Witte OW, Redecker C. Effect of skilled reaching training and enriched environment on generation of oligodendrocytes in the adult sensorimotor cortex and corpus callosum. BMC Neurosci. 2017 Mar 9;18(1):31.
Beckervordersandforth R, Ebert B, Schäffner I, Moss J, Fiebig C, Shin J, Moore DL, Ghosh L, Trinchero MF, Stockburger C, Friedland K, Steib K, von Wittgenstein J, Keiner S, Redecker C, Hölter SM, Xiang W, Wurst W, Jagasia R, Schinder AF, Ming GL, Toni N, Jessberger S, Song H, Lie DC. Role of Mitochondrial Metabolism in the Control of Early Lineage Progression and Aging Phenotypes in Adult Hippocampal Neurogenesis. Neuron. 2017 Feb 8;93(3):560-573.
Liu J, Prell T, Stubendorff B, Keiner S, Ringer T, Gunkel A, Tadic V, Goldhammer N, Malci A, Witte OW and Grosskreutz J (2016) Down-regulation of purinergic P2X7 receptor expression and intracellular calcium dysregulation in peripheral blood mononuclear cells of patients with amyotrophic lateral sclerosis Neuroscience Letter Sep 6;630:77-83.
Kunze A, Achilles A, Keiner S, Witte OW, Redecker C. (2015) Two distinct populations of doublecortin-positive cells in the perilesional zone of cortical infarcts. BMC Neurosci. 15;16:20.
Schultheiß C, Abe P, Hoffmann F, Mueller W, Kreuder AE, Schütz D, Haege S, Redecker C, Keiner S, Kannan S, Claasen JH, Pfrieger FW, Stumm R. (2013) CXCR4 prevents dispersion of granule neuron precursors in the adult dentate gyrus. Hippocampus. 23(12):1345-58.
Niv F., Keiner S., K-Krishna, Witte OW., Redecker C. (2012) Aberrant neurogenesis after stroke: a retroviral cell labeling study. Stroke 43(9):2468-75.
Beetz C, Pieber TR, Hertel N, Schabhüttl M, Fischer C, Trajanoski S, Graf E, Keiner S, Kurth I, Wieland T, Varga RE, Timmerman V, Reilly MM, Strom TM, Auer-Grumbach M. (2012) Exome sequencing identifies a REEP1 mutation involved in distal hereditary motor neuropathy type V. Am J Hum Genet. 13;91(1):139-45.
Geibig CS, Keiner S, Redecker C. (2012) Functional recruitment of newborn hippocampal neurons after experimental stroke. Neurobiol Dis. 46(2):431-9
Liebigt S, Schlegel N, Oberland J, Witte OW, Redecker C, Keiner S. (2012) Effects of rehabilitative training and anti-inflammatory treatment on functional recovery and cellular reorganization following stroke. Exp. Neurology 233(2);:776-82
Walter J, Keiner S, Witte OW, Redecker C. (2011) Age-related effects on hippocampal precursor cell subpopulations and neurogenesis. Neurobiol Aging. 32(10):1906-14.
Keiner S, Walter J, Oberland J, Redecker C. (2010) Contribution of constitutively proliferating precursor cell subtypes to dentate neurogenesis after cortical infarcts. BMC Neurosci. 17;11:146
Walter J, Keiner S, Witte OW, Redecker C. (2010) Differential stroke-induced proliferative response of distinct precursor cell subpopulations in the young and aged dentate gyrus. Neuroscience. 169(3):1279-86.
Axer H, Bernstein HG, Keiner S, Heronimus P, Sauer H, Witte OW, Bogerts B, Bär KJ. (2010) Increased neuronal cell number in the dorsal motor nucleus of the vagus in schizophrenia. Acta Neuropsychiatr. 22(1):26-34.
Keiner S., Witte OW., Redecker C. (2009) Immunocytochemical detection of newly generated neurons in the perilesional area of cortical infarcts after intraventricular application of brain-derived neurotrophic factor. J Neuropathol and Exp Neurol. 68(1):83-93.
Haase D, Keiner S, Mawrin C, Wolf G. (2009) Reduced Morg1 expression in ischemic human brain. Neurosci Lett. 8;455(1):46-50.
Axer H, Bernstein HG, Keiner S, Heronimus P, Sauer H, Witte OW, Bogerts B, Bär KJ. (2009) Erhöhte Neuronenzahl im Vaguskern bei schizophrenen Patienten. Klin Neurophysiol. 40 - P289
Keiner S., Wurm F., Kunze A., Witte OW., Redecker C. (2008) Rehabilitative therapies differentially alter proliferation and survival of glial cell populations in the perilesional zone of cortical infarcts. Glia 56(5):516-27
Wurm F, Keiner S, Kunze A, Witte OW, Redecker C. (2007) Effects of skilled forelimb training on hippocampal neurogenesis and spatial learning after focal cortical infarcts in the adult rat brain. Stroke. 38(10):2833-40.
Frahm C, Siegel G, Grass S, Witte OW. (2006) Stable expression of the vesicular GABA transporter following photothrombotic infarct in rat brain. Neuroscience. 140(3):865-77.
Kunze A, Grass S, Witte OW, Yamaguchi M, Kempermann G, Redecker C. (2006) Proliferative response of distinct hippocampal progenitor cell populations after cortical infarcts in the adult brain. Neurobiol Dis. 21(2):324-32.
Koordinatorin im Studiengang Molecular Medicine für das Modul “Neuroscience”
Vorlesungen and Praktika im Bereich Molecular Medicine
Vorlesungen für Pharmazeuten in Bereich Pharmakologie/Toxikologie
Dipl.-Ing. Madlen Haase
Cand. med. Luisa Fillipini
Cand. med. Julius Broesske
Cand. med. Magdalene Rippe
Cand. med. Anna-Lena Fleischer
Cand. med. Lucas Kaiser
Cand. med. Leander Löber
Cand. med. Anja Thomsen
Cand. med. Maydé Wallborn
Cand. med. Lennard Mehler
Cand. med. Hanna Gude
M. Sc. Ulrike Röchte
Dr. med. Tina Andrä
Dr. med. Antonia Blank
Dr. med. Edith Göller
Dr. med. Kassandra Reiche
Dr. med. Florus Woitke
Dr. med. Lina Karapetow
Dr. med. Max Rudolph
M. Sc. Gregor Stein
M. Sc. Leopold Wohlsperger
M. Sc. Jessica Mesterheide
M. Sc. Carolin Kathner
B. Sc. Jule Birnstein
B. Sc. Gina-Marie Lehmann
B. Sc. Lena Sablotny
B. Sc. Kristina Hänselmann
B. Sc. Theresa Simon
B. Sc. Judith Hidalgo
B. Sc. Pia Schweineberg
B. Sc. Sabrina Beersiek
B. Sc. Maximillian Jamin
B. Sc. Susanne Neumann
B. Sc.Tanja Steinbach
B. Sc. Melanie Storch

Fragestellung: Adhärenz beschreibt inwieweit Patienten die Vereinbarungen, die sie mit einem Arzt getroffen haben, einhalten wollen oder können. Schlechte Adhärenz oder Non-Adhärenz ist ein großes Versorgungsproblem, das auf Patientenebene mit erhöhter Morbidität und Mortalität einhergeht und auf gesundheitsökonomischer Ebene jährlich immense Kosten verursacht. Aufgrund des demografischen Wandels nimmt der Anteil an geriatrischen und vor allem neurogeriatrischen Patienten und damit auch die Polymedikation stetig zu, was das Problem der Non-Adhärenz mit all seinen Folgen verschärft. Interventionen zur Verbesserung der Adhärenz müssen krankheitsspezifische Aspekte berücksichtigen, um wirksam zu sein. Allerdings gibt es bislang keine umfassenden Daten zur Adhärenz bei neurogeriatrischen Patienten.
Methode: Diese prospektive Studie kombiniert daher eine umfassende Beobachtungsstudie mit einer interventionellen Studie: In der ersten Phase wird eine Beobachtungsstudie die detaillierte Bewertung und Identifizierung krankheitsspezifischer adhärenzmodulierender Faktoren bei neurogeriatrischen Patienten ermöglichen. Da es nach Entlassung aus dem Krankenhaus häufig zu Änderungen der Medikation kommt und dies die Adhärenz nachhaltig positiv oder negativ beeinflussen kann, werden wir auch diesen Prozess im Detail analysieren und dessen Auswirkungen auf die Adhärenz untersuchen. Auf der Grundlage dieser Daten werden wir komplexe und krankheitsspezifische Interventionen zur Verbesserung der Adhärenz entwickeln. In der zweiten Phase werden wir eine cluster-randomisierte Studie durchführen, um die Wirksamkeit (in Bezug auf die gesundheitsbezogene Lebensqualität und Adhärenz) und die Wahrnehmung (Hindernisse und Unterstützungsfaktoren der Implementierung) dieser Interventionen bei Patienten, Angehörigen und niedergelassenen Ärzten zu evaluieren.
Institut für medizinische Statistik, Informatik und Datenwissenschaften, Universitätsklinik für Altersmedizin Halle (Saale)
Interessenten für eine medizinsche Doktorarbeit wenden sich bitte mit Lebenslauf und Motivationschreiben direkt per E-Mail an
Studienkoordinatorin
Dr. phil. Ulrike Teschner
Wissenschaftliches und ärztliches Personal
Dr. med. Sarah Mendorf
Dr. med. Bianka Heiling
Dr. med. Nadine Fedtke
Promotionen
Lena Meyer
Sowie Psychologen und wissenschaftliche Hilfskräfte

Die AG Neuroimaging untersucht die Funktionsweise des menschlichen Gehirns mit Methoden der funktionellen Bildgebung. Dabei werden insbesondere die vielfältigen Interaktionen innerhalb des sensiblen Systems betrachtet.
Die gewonnenen Daten sollen später dazu beitragen, gezielte Therapiemöglichkeiten für verschiedenste neurologische Erkrankungen (Schlaganfall, chronische Schmerzen und v.a.) abzuleiten.
Publikationslink Dr. Carsten Klingner: http://www.ncbi.nlm.nih.gov/pubmed/?term=Klingner+Carsten
Publikationslink Dr. Stefan Brodoehl: http://www.ncbi.nlm.nih.gov/pubmed/?term=Brodoehl
sb_eye_movements_gui is a collection of MATLAB tools to create ROIs and segment eye bulbs from any MR images using different segmentation methods. It was created within the NeuroImaging Center of the Jena University Hospital in the Department of Neurology.
See below to download a picture workflow guiding you on the use of the matlab tool.
Please note that the software remains in a beta status. Major features have been rigorously tested by several members of our lab on several data sets. However, minor bugs remain.
If you find a severe bug, please report it to the corresponding author:
Dozenten:
Organisation:
Hörerkreis: alle interessierten Studenten/innen, Diplomanden, Doktoranden, Ärzte und Wissenschaftler
Link: Bildgebende Verfahren in den Neurowissenschaften: Grundlagen und aktuelle Ergebnisse
1. Normale und pathologische neurokognitive Veränderungen über die Lebensspanne
Über die Lebensspanne zeigen sich signifikante Veränderungen der Neurokognition, u.a. im Bereich der visuellen Aufmerksamkeit. Die Erfassung solcher Veränderungen bei gesunden Probanden dient der Charakterisierung normaler Alterungsprozesse und ihrer neuronalen Grundlagen. Davon abzugrenzen sind pathologische Veränderungen, die in allen Stadien der Lebensspanne auftreten können, aber gerade im hohen Alter besonders gravierend sind. In von der DFG und der EU geförderten Projekten führen wir eine kombinierte Erfassung von Verhaltensmaßen und neuronalen Daten bei gesunden Probanden und Patienten mit kognitiven Beeinträchtigungen durch. Ziel ist eine bessere Abgrenzung von normalen und pathologischen Veränderungsprozesse und ihrer jeweiligen neuronalen Grundlagen. Im Fokus der Patientenstudien stehen Patienten mit amnestischer leichter kognitiver Beeinträchtigung (amnestic Mild Cognitive Impairment, aMCI) mit hohem Risiko zur Entwicklung einer Alzheimer-Demenz, die wir im Gedächtniszentrum des UKJ untersuchen. Diese Untersuchungen sollen der verbesserten Frühdiagnostik dienen.
2. Möglichkeiten des neurokognitiven Enhancements bei Gesunden und Probanden mit Risiko für kognitiven Abbau
Nicht-invasive Methoden des neurokognitiven „Enhancement“ versprechen eine kognitive Leistungssteigerung, nicht nur bei jungen gesunden Probanden, sondern auch Populationen mit Risiko für kognitiven Abbau. Wir untersuchen die Möglichkeiten und Grenzen unterschiedlicher Methoden, wie z.B. des kognitiven Computertrainings oder der transkraniellen Gleichstromstimulation. Wir setzen diese Methoden bei gesunden Probanden unterschiedlicher Altersgruppen, sowie bei Patienten mit kognitiven Defiziten ein und überprüfen die Wirksamkeit mit Hilfe klinischer und experimenteller Diagnoseverfahren. Da nicht alle Probanden gleichermaßen von zeitaufwendigen neurokognitiven Interventionen profitieren, ist es wichtig, vorhersagen zu können, wer mit hoher Wahrscheinlichkeit einen Nutzen zeigen wird. Wir untersuchen, welche kognitiven und neuronalen Biomarker geeignet für eine solche Vorhersage sein könnten.
3. Früdiagnostik von Demenzrisiko mit telemedizinischen Verfahren
Die frühzeitige Identifikation von Patienten mit Demenzrisiko ist wichtig, um behandelbare Ursachen rechtzeitig zu identifizieren und für jeden Patienten die individuell richtige Behandlung zu initiieren. Notwendig ist dafür die Erkennung der Patienten in der Phase der sogenannten „leichten kognitiven Beeinträchtigung“, in der zwar ein geistiger Abbau vorliegt, die Alltagsfähigkeiten jedoch erhalten sind. In spezialisierten Zentren sind diese Patienten anhand von sensitiven neuropsychologischen Untersuchungsverfahren identifizierbar. Der Zugang dazu ist, insbesondere in ländlichen Regionen, für Menschen mit chronischen Erkrankungen und Mobilitätseinschränkungen erschwert. Eine entsprechend frühe Identifikation in der Hausarztpraxis vor Ort ist jedoch schwierig. Der Grund ist, dass die gängigen, dort verfügbaren kognitiven Screeningverfahren dafür nicht sensitiv genug sind.
Wir setzen auf eine Verbesserung der intersektoralen Kommunikationsstruktur durch neue, telemedizinisch nutzbare Technologien. Insbesondere wollen wir, Kooperation mit der Universität Oxford (Nele Demeyere) und der Telemedizin-Firma MEYTEC Informationssysteme GmbH die Diagnostik einer leichten kognitiven Beeinträchtigung mit einem Tablet-Test (OCS-Plus) und einer Virtuellen Realitätsbrille mit integriertem Blickbewegungsmessgerät (Eyetracker) verbessern. Ziel ist es, diese Instrumente zur Diagnostik in ländlichen Regionen verfügbar zu machen und so die dortige Früherkennung von Patienten mit Demenzrisiko zu verbessern.
4. Neuronale Konnektivität als Grundlage von visuellen Aufmerksamkeitsstörungen bei leichter kognitiver Beeinträchtigung
Die zunehmende Alterung der westlichen Gesellschaften hat die Früherkennung von Demenz zu einem vorrangigen Forschungsziel gemacht. Ältere Erwachsene mit leichter kognitiver Beeinträchtigung (“mild cognitive impairment”, MCI) weisen eine veränderte Konnektivität des Gehirns auf, die ein höheres Demenzrisiko signalisieren kann. Allerdings wird die veränderte Konnektivität des Gehirns bei MCI jedoch von den derzeitigen kognitiven Standardmessungen nicht gut erfasst, was den Nutzen dieser Messungen für die Bewertung der Krankheitserkennung und -progression oder der Wirksamkeit der Behandlung bei MCI einschränkt. Obwohl globale Gedächtnisprobleme das auffälligste kognitive Symptom bei Demenz sind, hat sich gezeigt, dass grundlegende Parameter der visuellen Aufmerksamkeit bei MCI beeinträchtigt sind. Daher könnten grundlegende Mechanismen der visuellen Aufmerksamkeit einigen Gedächtnisproblemen bei MCI zugrunde liegen, z. B. dem visuellen Szenengedächtnis. AttentionBrainConnect in MCI, ABC-MCI, wird daher eine innovative Aufgabe mit mathematischer Modellierung verwenden, um grundlegende Parameter der visuellen Aufmerksamkeit, ihren Zusammenhang mit der Konnektivität des Gehirns und ihren Einfluss auf das visuelle Szenengedächtnis bei MCI zu untersuchen. Die Parameter basieren auf der Theorie der visuellen Aufmerksamkeit, die Konnektivität des Gehirns auf der Grundlage der Magnetresonanztomographie und die Gedächtnisleistung auf der Grundlage einer Aufgabe zur Szenenerkennung. Letztlich könnte ABC-MCI neurokognitive Marker für eine bessere Erkennung der Krankheit und eine bessere Beurteilung des Krankheitsverlaufs sowie für die Bewertung der objektiven Wirksamkeit der Behandlung liefern.
Erfassung von altersbedingten kognitiven Veränderungen
Erstellung von Zusammenhängen zwischen behavioralen und neuronalen Daten:
Neurokognitives Enhancement
TMASFF - Thüringer Ministerium für Arbeit, Soziales, Frauen und Familie, 2018-2020, TELE-FRED „Pilotinstallation zur telemedizinischen Früherkennung von Demenzerkrankungen im ländlichen Regionen Thüringens.
DFG Forschergruppe FOR 2293 “Active Perception” Fi 1424/2-2, 2019-2021, Teilprojekt “Aging and the effect of predictability and utility on perception“.
DFG Forschergruppe FOR 2293 “Active Perception” Fi 1424/2-1, 2016-2019, Teilprojekt “Active Perception and functional connectivity in normal and pathological aging“.
EU Marie Curie Initial Training Network, ITN-2013-606901, 2014-2017, “Individualized Diagnostics and Rehabilitation of Attentional Disorders” (INDIREA). PI of project at LMU “Structural and Intrinsic functional connectivity in relation to visual attention in healthy and pathological aging”.
(vollständige Publikationsliste unter: http://www.ncbi.nlm.nih.gov/pubmed/?term=Kathrin+Finke)
Ruiz-Rizzo, A. L., Sorg, C., Napiorkowski, N., Neitzel, J., Menegaux, A., Müller, H. J., Vangkilde, S. & Finke, K. (2018). Decreased cingulo-opercular network functional connectivity mediates the impact of aging on visual processing speed. Neurobiology of Aging. doi.org/10.1016/j.neurobiolaging.2018.09.014.
Haupt, M., Sorg, C., Napiórkowski, N., & Finke, K. (2018). Phasic alertness cues modulate visual processing speed in healthy aging. Neurobiology of Aging, 70, 30-39.
Künstler, E. C. S., Penning, M. D., Napiórkowski, N., Klingner, C. M., Witte, O. W., Bublak, P., & Finke, K. (2018). Dual task effects on visual attention capacity in normal aging. Frontiers in Psychology, 9, 1564.
Ruiz-Rizzo, A. L., Bublak, P., Redel, P., Grimmer, T., Müller, H. J., Sorg, C., & Finke, K. (2017). Simultaneous object perception deficits are related to reduced visual processing speed in amnestic mild cognitive impairment. Neurobiology of Aging, 55, 132-142.
Menegaux, A., Meng, C., Neitzel, J., Bäuml, J. G., Müller, H. J., Bartmann, P., Wolke, D., Wohlschläger, A.M., Finke, K. & Sorg, C. (2017). Impaired visual short-term memory capacity is distinctively associated with structural connectivity of the posterior thalamic radiation and the splenium of the corpus callosum in preterm-born adults. Neuroimage, 150, 68-76.
Neitzel, J., Ortner, M., Haupt, M., Redel, P., Grimmer, T., Yakushev, I., Drzezga, A., Bublak, P., Preul, C., Sorg, C. & Finke, K. (2016). Neuro-cognitive mechanisms of simultanagnosia in patients with posterior cortical atrophy. Brain, 139(12), 3267-3280.
Gögler, N., Willacker, L., Funk, J., Strube, W., Langgartner, S., Napiórkowski, N., Hasan, A. & Finke, K. (2016). Single-session transcranial direct current stimulation induces enduring enhancement of visual processing speed in patients with major depression. European Archives of Psychiatry and Clinical Neuroscience.
Wiegand, I., Finke, K., Töllner, T., Starman, K., Müller, H. J., & Conci, M. (2015). Age-related decline in global form suppression. Biological Psychology, 112, 116-124.
Schubert, T., Finke, K., Redel, P., Kluckow, S., Müller, H.J., & Strobach, T. (2015). TVA-based assessment of multiple visual attention aspects in persons with video game experience: the role of personality traits and of training. Acta Psychologica, 157, 200-214.
LMU Munich, Psychology
Prof. Hermann J. Müller, PD Markus Conci, PD Thomas Töllner
LMU Munich, Psychiatry
Prof. Frank Padberg, PD Hasan Alkomeit
TUM Munich, Hospital Rechts der Isar, Neuro-Head-Center
PD Christian Sorg
Oxford University, Experimental Psychology
Prof. Anna Christina Nobre, Prof. Masud Husain, Dr. Nele Demeyere
University of Copenhagen, Center of Visual Cognition (CVC)
Prof. Claus Bundesen, Prof. Thomas Habekost, Dr. Signe Vangkilde, Dr. Anders Petersen
Charité Berlin, Neurology
PD Antje Kraft
Max-Planck-Institute for Educational Research Berlin
Dr. Iris Wiegand
Bielefeld University, Excellence cluster CITEC
Prof. Werner X. Schneider, Dr. Christian Poth
Martin-Luther University Halle-Wittenberg, Psychology
Prof. Torsten Schubert
MSH Medical School Hamburg, Psychology
Prof. Tilo Strobach
Chemnitz University, Physics of Cognitive Processes
Prof. Einhäuser-Treyer
Team
Alumni
Erkrankungen und Schädigungen des Gehirns können zwar durchaus sehr selektive, d.h. nur einzelne Teilfunktionen (z.B. das Neugedächtnis) betreffende Ausfälle nach sich ziehen. Weit häufiger findet sich aber eine eher globale, d.h. die Mehrzahl oder sogar alle geistigen Funktionen berührende Beeinträchtigung, die in ihrem Ausmaß stark variieren kann. Typischerweise ist dies z.B. bei Systemerkrankungen, neurodegenerativen Erkrankungen oder entzündlichen Erkrankungen der Fall. Die Ursache dafür liegt darin begründet, dass solche Pathologien diffus verteilte Schädigungen kortikaler und subkortikaler Bereiche verursachen. Damit stören sie die Interaktion innerhalb weit verzweigter Netzwerke, welche die Grundlage der zerebralen Verarbeitungskapazität darstellen. Diese ist einerseits abhängig von der Geschwindigkeit kognitiver Basisprozesse und andererseits von der Fähigkeit, aufgabenrelevante Informationen kurzzeitig im Bewusstsein zu halten. Damit werden komplexe Denkleistungen erst möglich. Neben kortikalen Assoziationsarealen und dem subkortikalen Marklager tragen zur Verarbeitungskapazität verschiedene Neurotransmitter-Systeme (z.B. das cholinerge System) entscheidend bei. Wir untersuchen - mittels experimentalpsychologischer Methoden auf der Basis der „Theorie der visuellen Aufmerksamkeit“ (Bundesen et al., 2005) - Zusammenhänge zwischen Erkrankungen und einer reduzierten Verarbeitungskapazität, sowie deren Auswirkungen auf die kognitive Leistungsfähigkeit insgesamt. Neben grundlagenwissenschaftlichen Erkenntnissen über den Aufbau unserer kognitiven Architektur und ihrer zerebralen Grundlagen sollen damit auch Verbesserungen in der Diagnostik und Behandlung der von Gehirnerkrankungen hervorgerufenen Leistungsminderungen erzielt werden.
Bublak P, Redel P, Sorg C, Kurz A, Förstl H, Müller HJ, Schneider WX, Finke K. Staged decline of visual processing capacity in mild cognitive impairment and Alzheimer's disease. Neurobiol Aging, 2009 Aug 25.
Finke K, Bucher L, Kerkhoff G, Keller I, von Rosen F, Geyer T, Müller H, Bublak P. Inhibitory and facilitatory location priming in patients with left-sided visual hemi-neglect. Psychol Res., 2009, 73: 177-85.
Finke K, Bublak P, Dose M, Müller HJ, Schneider WX. Parameter-based assessment of spatial and non-spatial attentional deficits in Huntington's disease. Brain, 2006, 129:1137-51.
Bublak P, Finke K, Krummenacher J, Preger R, Kyllingsbaek S, Müller HJ, Schneider WX. Usability of a theory of visual attention (TVA) for parameter-based measurement of attention II: evidence from two patients with frontal or parietal damage. J Int Neuropsychol Soc, 2005, 11:843-54.
Bublak P, Müller U, Grön G, Reuter M, von Cramon DY. Manipulation of working memory information is impaired in Parkinson's disease and related to working memory capacity. Neuropsychology, 2002, 16:577-90.
Bublak P, Redel P, Sorg C, Kurz A, Förstl H, Müller HJ, Schneider WX, Finke K. Staged decline of visual processing capacity in mild cognitive impairment and Alzheimer's disease. Neurobiol Aging, 2009 Aug 25.
Finke K, Bucher L, Kerkhoff G, Keller I, von Rosen F, Geyer T, Müller H, Bublak P. Inhibitory and facilitatory location priming in patients with left-sided visual hemi-neglect. Psychol Res., 2009, 73: 177-85.
Finke K, Bublak P, Dose M, Müller HJ, Schneider WX. Parameter-based assessment of spatial and non-spatial attentional deficits in Huntington's disease. Brain, 2006, 129:1137-51.
Bublak P, Finke K, Krummenacher J, Preger R, Kyllingsbaek S, Müller HJ, Schneider WX. Usability of a theory of visual attention (TVA) for parameter-based measurement of attention II: evidence from two patients with frontal or parietal damage. J Int Neuropsychol Soc, 2005, 11:843-54.
Bublak P, Müller U, Grön G, Reuter M, von Cramon DY. Manipulation of working memory information is impaired in Parkinson's disease and related to working memory capacity. Neuropsychology, 2002, 16:577-90.

Alterung ist mit einem progressiven Verlust an Organ- und Gewebehomöostase verbunden und stellt einen der wichtigsten Suszeptibilitätsfaktoren für Neurodegeneration dar. Forschungsschwerpunkt in der AG ist die Charakterisierung zellulärer und molekularer Prozesse, die einen Verlust der Proteinhomöostase im zentralen Nervensystem bewirken und altersabhängig in Dysfunktionalität, regenerative Erschöpfung und Degeneration einmünden. Im Mittelpunkt stehen dabei Störungen der subzellulären Proteinhomöostase, Kompartiment-spezifische Transportprozesse und ihre Auswirkungen auf Alters-assoziierte Krankheitsinduktion und -Progression.
Darüber hinaus werden molekulare Prozesse gestörter Integrität chromosomaler, telomerischer und extrachromosomaler DNA sowie mobiler DNA-Elemente im Kontext der ZNS-Alterung sowie neurodegenerativer Prozesse analysiert.
Übergeordnetes Ziel ist die Identifikation von Strategien zur Restitution der Proteinhomöostase sowie der Förderung gesunder ZNS-Alterung.
Erkenntnisse zur axonalen Wachstumskodierung sollen neue Perspektiven für therapeutische klinische Ansätze, z.B. nach traumatischer Rückenmarksläsion, im Rahmen der ischämischen oder entzündlichen Opticusneuritis und der Multiplen Sklerose eröffnen.
Abb.1:
A. Neuritenwachstum deafferentierter retinalen Ganglienzellen (RGZ) in Kultur.
B. „Whole mount“ Präparat einer Retina. Grün: RGZ; rot: Müller-Glia.
C. Schematische Darstellung der retino-tectalen Projektion und angewandte Interventionen.
derzeit IZKF
Kretz A., Marticke J.K., Happold C.J., Schmeer C., Isenmann S. A primary culture technique of adult retina for regeneration studies on adult CNS neurons. Nature Protocols 2: 131-140, 2007.
Kretz A., Kügler S., Happold C., Bähr M., Isenmann S. Excess Bcl-XL increases the intrinsic growth potential of adult CNS neurons in vitro. Mol Cell Neurosi 26: 63-74, 2004.
Kretz A., Happold C., Marticke J., Isenmann S. Erythropoietin promotes CNS regeneration via Jak2/Stat3 and PI3K/AKT pathway activation. Mol Cell Neurosi 29: 569-579, 2005.
Kretz A., Jacob A.M., Tausch S., Straten G., Isenmann S. Regulation of GDNF and its receptor components GFR-α1, -α2 and Ret during development and in the mature retino-collicular pathway. Brain Res 1090: 1-14, 2006.
Isenmann S., Kretz A., Cellerino A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res 22, 483-543, 2003.

Link zur Webseite der Arbeitsgruppe
Weitere Informationen folgen...

Der Forschungsschwerpunkt unserer Arbeitsgruppe „Motorisches Verhalten“ liegt in der Untersuchung der funktionellen Erholung motorischer Beeinträchtigungen, wie sie beispielsweise durch einen Schlaganfall hervorgerufen wurden. Chronische motorische Defizite setzten die Lebensqualität von Schlaganfallpatienten stark herab. Das Ziel angewendeter Therapien ist es, diese motorischen Beeinträchtigungen zu minimieren. Betroffene Patienten sollen lernen, die alltäglichen Dinge des Lebens (z.B. Ankleiden, Waschen, Essen) wieder eigenständig zu erledigen. Eine erfolgreiche Bewegungstherapie bei chronischen motorischen Defiziten wird in unserer Klinik (Tagesklinik, Taub’sches Bewegungstraining) angeboten. Dabei wird sichergestellt, dass die Patienten den beeinträchtigten Arm intensiv trainieren. Die Therapie zeigt deutliche Erfolge. Es ist darüber hinaus für uns von großem Interesse, effektive Therapien zu entwickeln, die in der akuten und subakuten Phase nach dem Schlaganfall eingesetzt werden können.
Experimentelle Studien haben gezeigt, dass Tiere, die in einer reiz-intensiven komplexen Umgebung (geräumiger Käfig, verschiedene Utensilien wie Röhren, Wippen, Leitern) leben, feinmotorische Aufgaben nach einem induzierten Schlaganfall wesentlich erfolgreicher bewältigen. Durch pharmakologische Beeinflussung des Katecholamin-Systems lässt sich die funktionelle Erholung zusätzlich steigern.

Erklärungen zur Abbildung Greifbewegung: Das Hochziehen (Lift) schließt das Heben der Vorderpfote und Supinieren der Pfote ein, so dass die Handfläche nach innen zeigt und die Finger mit der Mediansagittale des Körpers eine Linie bilden. Beim Zielen (Aim) bewegt sich der Ellenbogen zur Mittellinie, während die Finger ihre Position beibehalten. Das Annähern (Advance) der Vorderextremität wird durch eine Schulterbewegung ermöglicht, dabei werden die Finger geöffnet und die Pfote teilweise proniert. Die Pronation (Pronation) wird erreicht durch das Abspreizen des Ellenbogens und einer Rotation um das Handgelenk. Im Griff (Grasp) schließen sich die Finger um das Futterpellet, danach folgt eine Flexion des Handgelenkes, um das Futterpellet anzuheben. Die anschließende Supination ist zweistufig, zuerst wird die Pfote zur Mittellinie supiniert, damit sie durch den Spalt zurückgezogen werden kann. Dann wird die Pfote nochmals supiniert, um das Pellet freizugeben. Beachte, dass Kopf und Körper während des Griffes kaum bewegt werden. Eine Ausnahme bildet die Kopfbewegung vor dem eigentlichen Griff, die die Nase beim Riechen des Pellets (Ortung) unterstützt. Dann wird der Oberkörper gehoben, um der Pfote das Vorrücken zu erlauben. Die Pfeile kennzeichnen die Bewegungen. Abbildung modifiziert nach Whishaw et al., 2000.

Wir beschäftigen in einem klinisch-translationalen Ansatz mit Schlafstörungen bei neurodegenerativen, neuroinflammatorischen und neurovaskulären Erkrankungen. Der breite Bogen unseres Forschungsinteresses reicht von systemphysiologischen Untersuchungen zu spezifischen Schlafstörungen über populationsbezogenen epidemiologische Fragestellungen, die Entwicklung und Validierung von Screeninginstrumenten und Biomarkern bis zu Fragen der medizinischen Versorgung von Menschen mit Schlafstörungen im klinischen Alltag.
76 – 92 % aller MS Patienten leiden unter einer Fatigue Symptomatik und 42-54 % an einer Depression. Unabhängig vom Ausmaß der neurologisch-funktionellen Beeinträchtigung sind Fatigue und Depression wesentliche Prädiktoren der eingeschränkten Lebensqualität bei Patienten mit MS. Schlafstörungen sind wesentliche Kardinalsymptome bei Depression und Fatigue, gehen der Erkrankungsmanifestation häufig voraus und sind ein unabhängiger Risikofaktor für diese Erkrankungen. Systematische, epidemiologische Untersuchungen zur Prävalenz und Art von Schlafstörungen in Abhängigkeit von Krankheitsstatus und psychischen Komorbiditäten bei Patienten mit MS fehlen. Diese Fragen versuchen wir in einem in einem multizentrischen Ansatz mit 26 Studienzentren und über 2000 Patienten zu klären. Des Weiteren wollen wir in grundlegenden Studien die Ursache der Schlafstörungen im Zusammenhang mit der chronischen Entzündungsreaktion verstehen lernen.
Studien:
Funding: Novartis
Publikationen: in Vorbereitung
Vor dem Hintergrund der demografischen Altersverschiebung nimmt die Prävalenz neurodegenerativer Erkrankungen deutlich zu. Im Hinblick auf zukünftige präventive Therapieansätze ist eine frühzeitige Erkennung einer Prädisposition für neurodegenerativen Erkrankungen nötig, um eine entsprechende Risikostratifizierung und frühzeitige Therapieeinleitung zu gewährleisten. Die idiopathische REM-Schlafverhaltensstörung ist eine seltene Parasomnie, gekennzeichnet durch den Verlust der physiologischen REM-Atonie und konsekutives Ausagieren von Trauminhalten. Ein Großteil der Patienten mit einer REM-Schlafverhaltensstörung entwickeln im weiteren Krankheitsverlauf eine neurodegenerative Erkrankung aus dem Formenkreis des Mb. Parkinson. Da die die REM-Schlafverhaltensstörung der eigentlichen Manifestation der neurodegenerativen Erkrankung Jahre bis Jahrzehnte voraus geht, lassen sich durch systemphysiologische Untersuchungen frühe Biomarker und Screeninginstrumente für Erkrankungen aus dem Formenkreis des Mb. Parkinson entwickeln. Zu diesem Zweck etablierten wir die Mitteldeutsche REM-Schlafverhaltensstörungs-Kohorte, die systematisch charakterisiert und regelmäßig nachuntersucht wird.
Studie:
Funding:
Publikationen:
10 Prozent der erwachsenen deutschen Bevölkerung leiden unter behandlungsbedürftigen Ein-und Durchschlafstörungen. Der Schlaf erfüllt eine fundamentale Rolle in der homöostatischen Regulation höherer Hirnfunktionen. So finden während des Schlafes eine Drainierung des Gehirns von toxischen Metaboliten und Eiweissabbauprodukten statt. Des Weiteren findet während des Schlafes eine Reorganisation der Synapsen als Grundvorrausetzung der zerebralen Plastizität statt. In diesem Forschungsprojekt untersuchen wir, inwieweit chronische Ein- und Durchschlafstörungen diese homöostatischen Prozesse stören und für neurokognitive und neurodegenerativen Veränderungen prädisponieren. Ob eine Wiederherstellung der Schlafqualität durch kognitive Verhaltenstherapie oder pharmakologische Ansätze die negativen Effekte des chronischen Schlafmangels rückgängig machen kann, soll in nachfolgenden Untersuchungen geklärt werden.
Studien:
Funding:
Publikationen:
Die Differenzialdiagnose der Narkolepsie in Abgrenzung zu anderen zentralnervösen Hypersomnien ist eine Herausforderung in der klinisch-somnologischen Praxis. Spezifische diagnostische Biomarker wie verminderte Hypocretinspiegel im Liquor sind nur für die die Narkolepsie mit Kataplexie (Narkolepsie Typ 1) etabliert. Neurokognitive Veränderungen bei zentralnervösen Hypersomnien umfassen nicht nur die zentralnervöse Aktivierung (Alertness) sondern auch andere neurokognitive Domänen wie Aufmerksamkeit, Informationsverarbeitungsgeschwindigkeit, Gedächtnis und psychomotorische Leistungen. Unklar ist, wie sich die neurokognitiven Veränderungen zwischen den einzelnen Krankheitsentitäten der zentralnervösen Hypersomnien unterscheiden. In diesem Forschungsprojekt wollen wir die neurokognitiven Profile der unterschiedlichen zentralnervösen Hypersomnien charakterisieren um neurokognitive Biomarker in der Differenzialdiagnose der Narkolepsie zu entwickeln und um Behandlungseffekte besser einschätzen zu können.
Studien:
Funding:
Publikationen:
ausstehend
Arteriosklerotische Gefäßwandveränderungen der Halsschlagader (A. carotis) sind eine Hauptursache für den thrombembolischen Schlaganfall. Prädilektionsstelle der arteriosklerotischen Veränderungen ist die Karotisgabel (Bulbus caroticus) mit der Aufzweigung in den internen und externen Karotisast. Im Bulbus caroticus sind Baro- und Chemorezeptor als wesentliche Komponenten der Kreislauf- und Atemregulation lokalisiert. Arteriosklerotische Gefäßveränderungen im Bulbus caroticus stören die Funktion dieser Rezeptoren, was zu einer autonomen Dysregulation mit Sympathoexzitation und Verlust des vagalen Tonus sowie dem Auftreten einer nächtlichen zentralen Atemregulationsstörung (zentrale Schlafapnoe) führt. Die autonome Dysregulation verstärkt kardiovaskuläre Risikofaktoren wie arteriellen Hypertonus und Diabetes mellitus und verstärkt die systemische Entzündungsreaktion. Wir untersuchen diese Zusammenhänge und therapeutische Möglichkeiten. So scheint sich eine chirurgische Desobliteration der Gefäßveränderungen (Thrombendarteriektomie) nicht aber eine transluminale Angioplastie (Stenting) positiv auf die Chemo- und Barorezeptorstörung auszuwirken.
Studien:
Funding:
Publikationen:
75% aller Patienten mit koronarer Herzerkrankung leiden an einer behandlungsbedürftigen schlafbezogenen Atemstörung (Schlafapnoe). Nach einer koronaren Bypass-OP erhöht das Vorliegen einer mittel- bis schwergradigen Schlafapnoe maßgeblich die Rate an postoperativen schwerwiegenden Komplikationen und die Sterblichkeitsrate. Dabei stehen nicht kardiorespiratorische sondern septisch-infektiöse Komplikationen im Vordergrund. Hinsichtlich der Unterscheidung zwischen obstruktiver und zentraler Schlafapnoe scheint das Vorliegen einer zentralen Schlafapnoe diese Risiko noch einmal zu potenzieren. Da Screeninginstrumente wie Fragebögen, Messung des Halsumfanges oder des Body-Mass- Index Patienten mit einer schwergradigen Schlafapnoe nicht sicher identifizieren können ist ein präoperatives polygraphisches Schlafapnoescreening vor einer elektiven koronaren Bypass-OP zu empfehlen. Inwieweit die präoperative Einstellung auf eine nächtliche Überdruckbeatmung das postoperative Risiko zu senken vermag, muss weiterführend untersucht werden.
Studie:
Funding:
Publikationen:
• Konzeption, Durchführung und biometrische Analyse multi- und monozentrischer klinischer Studien unter Berücksichtigung von GCP, GEP-Standards.
• Lineare und nichtlineare EEG-Analysen
• Lineare und nichtlineare Analysen des autonomen Nervensystems (Herzfrequenzvariabilität, Baroreflexsensitivität, Chemoreflexsensitivität, Kopplungsanalysen)
• Chronobiologische Analysen (Cosinor-basierte Rhythmometrie, Kopplungsanalysen)
• Neurokognitive Untersuchungsmethoden zu Alertness und Vigilanz und zerebraler Verarbeitungskapazität (in Kooperation mit der AG Neuropsychologie)
Rupprecht S, S. Finn S, Hoyer D, Guenther A, Witte O.W, Schultze T, Schwab M. Systemic inflammation in arteriosclerotic disease is mediated by carotid arteriosclerosis mediated dysfunction.
Translational Stroke Research 2020, 202011(1):50-59Rupprecht S, Schönfeld D, Kroegler N, Witte OW, Schwab M, Paditz E. „To rout or snort in the sleepe” a detailed medical description of sleep-disordered breathing and its consequences by Georg Grau in 1688.
The European Respiratory Journal 2019: 53(5);pii:1801799de la Motte T, Schwab M, Schultze T, Witte OW, Rupprecht S. An 82 year old man with sleep onset insomnia, breathing arrest and heart failure.
Chest 2019:156(5):e95-e98.Bramer D, Gunther A, Rupprecht S, Nowack S, Adam J, Meyer F, Schwab M, Surber R, Witte, Hoyer H, Hoyer D. Very Low Frequency Heart Rate Variability Predicts the Development of Post-Stroke Infections.
Translational Stroke Research 2019:10(6):607-619
Koranyi N, Meinhard M, Bublak P, Witte OW, Rupprecht S. Automatic affective responses towards the bed in patients with primary insomnia: evidence for a negativity bias.
Journal of Sleep Research 2018: 27(2): 215-219.
Rupprecht S, Schultze T, Nachtmann A, Rastan AJ, Doenst T, Schwab M, Witte OW, Rohe S, Zwacka I, Hoyer H. Impact of sleep disordered breathing on short-term post-operative outcome after elective coronary artery bypass graft surgery: a prospective observational study.
The European Respiratory Journal 2017: 49(4).
Muller JJ, Schwab M, Rosenfeld CR, Antonow-Schlorke I, Nathanielsz PW, Rakers F, Schubert H, Witte OW, Rupprecht S. Fetal Sheep Mesenteric Resistance Arteries: Functional and Structural Maturation.
Journal of Vascular Research 2017: 54(5): 259-271.
Rupprecht S, Finn S, Ehrhardt J, Hoyer D, Mayer T, Zanow J, Guenther A, Schwab M. Autonomic outcome is better after endarterectomy than after stenting in patients with asymptomatic carotid stenosis.
Journal of Vascular Surgery 2016: 64(4): 975-984.
Rupprecht S. Reply. Journal of Vascular Surgery. 2016: 64(5): 1550-1551.
Dahms C, Guenther A, Schwab M, Schultze T, Nowack S, Hoyer D, Ehrhardt J, Witte OW, Mayer G, Rupprecht S. Dysautonomia in prodromal alpha-synucleinopathy: peripheral versus central autonomic degeneration. European Journal of Neurology 2016: 23(5): 878-890.
Ehrhardt J, Schwab M, Finn S, Guenther A, Schultze T, Witte OW, Rupprecht S. Sleep apnea and asymptomatic carotid stenosis: a complex interaction.
Chest 2015: 147(4): 1029-1036.
Rupprecht S, Walther B, Gudziol H, Steenbeck J, Freesmeyer M, Witte OW, Gunther A, Schwab M. Clinical markers of early nigrostriatal neurodegeneration in idiopathic rapid eye movement sleep behavior disorder. Sleep Medicine 2013: 14(11): 1064-1070.
Rupprecht S, Grimm A, Schultze T, Zinke J, Karvouniari P, Axer H, Witte OW, Schwab M. Does the clinical phenotype of fatal familial insomnia depend on PRNP codon 129 methionine-polymorphism?
Journal of clinical sleep medicine : JCSM : official publication of the American Academy of Sleep Medicine 2013: 9(12): 1343-1345.
Rupprecht S, Witte OW, Schwab M. Gastroesophageal reflux in differential diagnosis of unclear nocturnal paroxysmal motor events.
Sleep Medicine 2012: 13(9): 1205-1206.
Rupprecht S, Hoyer D, Brehm B, Witte OW, Schwab M. REM sleep related bradyarrhythmia syndrome: Vagal overactivity or dysfunction of the cardiac conduction system?
Sleep Medicine 2011: 12(3): 308.
Rupprecht S, Hoyer D, Hagemann G, Witte OW, Schwab M. Central sleep apnea indicates autonomic dysfunction in asymptomatic carotid stenosis: a potential marker of cerebrovascular and cardiovascular risk. Sleep 2010: 33(3): 327-333.
Zinke J, Rupprecht S, Schwab M, Hagemann G. Nocturnal groaning (catathrenia) and epilepsy.
Epileptic disorders : international epilepsy journal with videotape 2010: 12(2): 136-137.
Rupprecht S, Schwab M, Fitzek C, Witte OW, Terborg C, Hagemann G. Hemispheric hypoperfusion in postictal paresis mimics early brain ischemia.
Epilepsy Research 2010: 89(2-3): 355-359.
Rupprecht S, Hagemann G, Witte OW, Schwab M. Alveolar hypoventilation as an early symptom of muscle weakness in facioscapulohumeral muscular dystrophy.
Sleep Medicine 2009: 10(5): 592-593.
Rupprecht S, Hutschenreuther J, Brehm B, Figulla HR, Witte OW, Schwab M. Causality in the relationship between central sleep apnea and paroxysmal atrial fibrillation.
Sleep Medicine 2008: 9(4): 462-464.
Rupprecht S, Franke K, Fitzek S, Witte OW, Hagemann G. Levetiracetam as a treatment option in non-convulsive status epilepticus.
Epilepsy Research 2007: 73(3): 238-244.
Richter F, Rupprecht S, Lehmenkuhler A, Schaible HG. Spreading depression can be elicited in brain stem of immature but not adult rats.
Journal of Neurophysiology 2003: 90(4): 2163-2170.
Das verzögert auftretende sekundäre ischämische Defizit ist die bedeutendste Ursache für neurologische Ausfallerscheinungen bei Patienten mit initial überlebter Subarachnoidalblutung (SAB). Trotz des beachtlichen Fortschritts in der neurovaskulären Bildgebung zur Detektion des Auftretens zerebraler Vasospasmen, bleiben die präventiven und therapeutischen Möglichkeiten zur Behandlung dieser Komplikation limitiert und ohne Verbesserung der klinischen Prognose für betroffene Patienten, was auf die unzureichend verstandene Pathogenese der sekundären Perfusionsdefizite zurückzuführen ist. Vorangehende Studien zeigten, dass Hämabbauprodukte, die aus dem intrakraniellen Hämatom um rupturierte Gefäßaneurysmen stammen, in erhöhten Konzentrationen im Liquor von SAB-Patienten nachweisbar bleiben. Diese Abbauprodukte zeigten im Tiermodell eine Vasoaktivität im Sinne einer Vasokonstriktion von zerebralen Arteriolen. Arterielle Vasospasmen sind nicht nur auf das Gehirn beschränkt, sondern auch in retinalen Gefäßen von Patienten mit altersassoziierten Erkrankungen wie Makuladegeneration, Glaukom sowie diabetischer und hypertensiver Retinopathie nachweisbar.
Mithilfe von Zwei-Photonen Lasermikroskopie und der hochauflösenden funktionellen MR-Bildgebung bei einer Feldstärke von 9,4T soll der vasoaktive Effekt intrathekal applizierter Hämabbauprodukte auf Arteriolen und Kapillaren durch Messung funktioneller Parameter wie den zerebralen Blutfluss untersucht werden. Das Auge als diagnostisches Fenster zum Gehirn eröffnet darüber hinaus die Möglichkeit, die Wirkung intraokulär injizierter Hämabbauprodukte auf Mikrogefäße der Netzhaut der Maus mittels nicht-invasiver dynamischer Gefäßanalyse zu bestimmen.
Dieses Projekt verfolgt das Ziel, den Pathomechanismus und die potentiell auslösenden Faktoren zur Entstehung zerebraler und retinaler Vasospasmen weiter aufzuklären. Die hierbei gewonnenen Erkenntnisse können einen wichtigen Beitrag zur Entwicklung neuer Therapieoptionen zur Verhinderung Vasospasmus-bedingter ischämischer Defizite liefern.
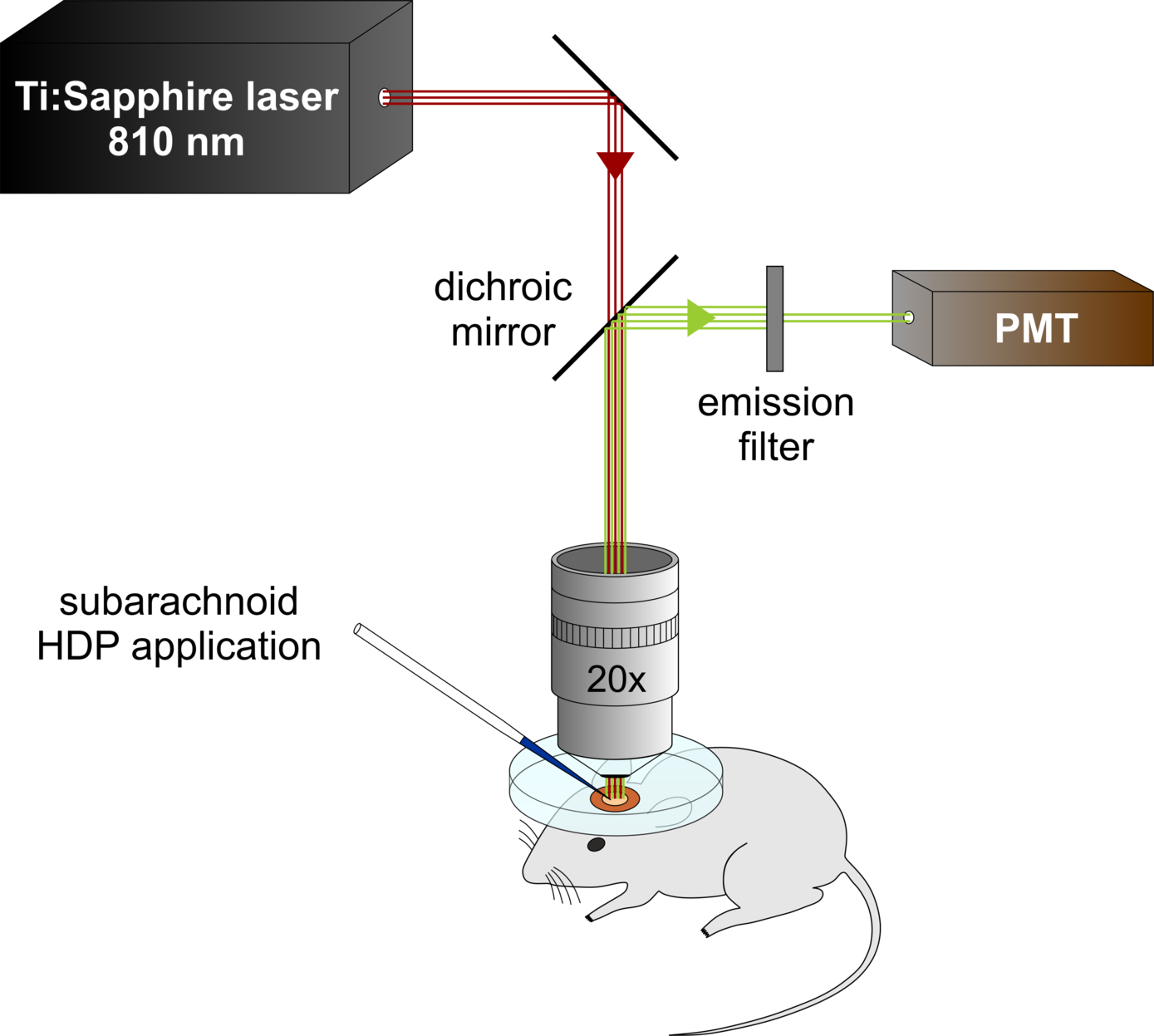
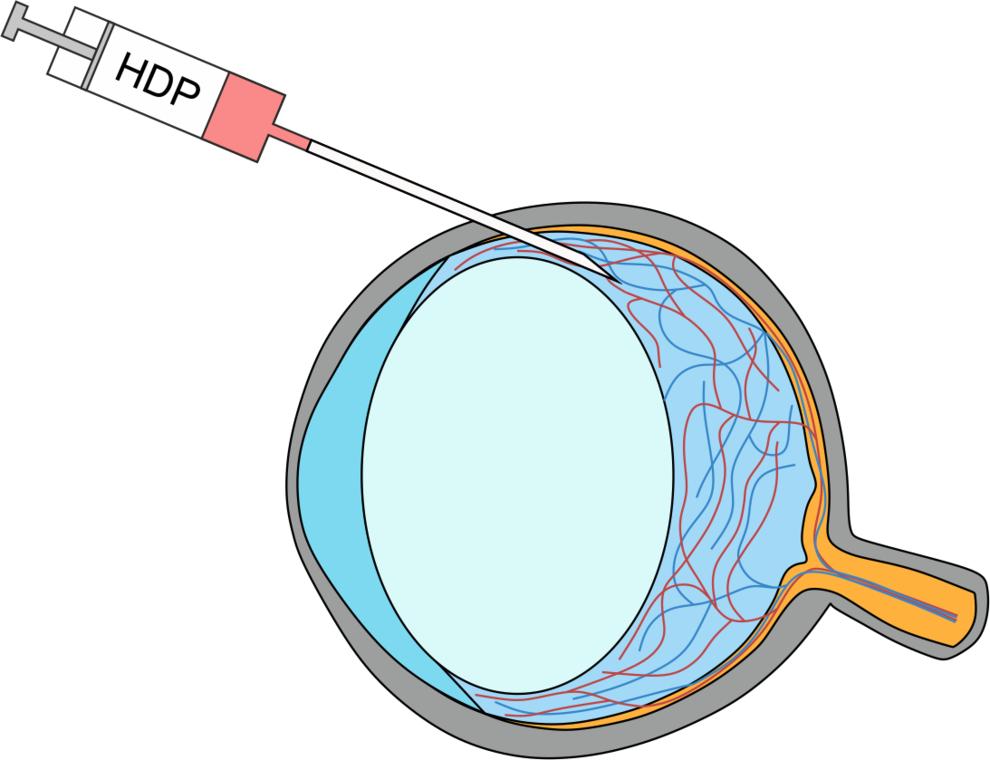

Dr. rer. nat. Jenny Rinke
Dr. med. Dr. rer. nat. Alexander Kaiser, M.Sc.
Dr. med. Sebastian Birndt
Maximilian Böhme (PhD-Doktorand)
Therese Wolfrum (PhD-Doktorandin)
Anja Waldau (MTA)
Die Arbeitsgruppe beschäftigt sich mit der molekularen Pathogenese, Diagnostik und Therapie von myeloproliferativen Neoplasien (MPN) mit dem Schwerpunkt der chronischen myeloischen Leukämie (CML). In enger Verknüpfung zwischen Klinik und Labor werden mehrere translationale Forschungsprojekte aus den Bereichen der Molekulargenetik, Epigenetik, klonalen Evolution und des Alterns bearbeitet. Unter Verwendung modernster Sequenzierungstechniken (Pyrosequenzierung, Next-Generation-Sequencing) und Array-Technologie werden Genom-weite Untersuchungen zu genetischen und epigenetischen Veränderungen durchgeführt und im Zellmodell funktionell charakterisiert. Die gewonnenen Daten werden in Zusammenschau mit klinischen Parametern (z.B. Therapieansprechen und Krankheitsverlauf) analysiert und korreliert. Hierdurch können neue prognostische Marker und molekulare Zielstrukturen identifiziert werden, was zur Entwicklung neuer zielgerichteter Therapien für betroffene Patienten beitragen könnte.
Bei Interesse an einer experimentellen Doktorarbeit bitte Prof. Dr. Ernst kontaktieren.
Bundesministerium für Bildung und Forschung (BMBF), Deutsche José-Carreras-Leukämie-Stiftung, Interdisziplinäres Zentrum für Klinische Forschung (IZKF)
Fallbesprechung und Instant Aging
Semesterübergreifende Veranstaltungen
Weiterführende Informationen zur Forschung an der Klinik für Geriatrie finden Sie hier.
Mein Interesse an der Thematik des Else Kröner-Forschungskollegs AntiAge Jena begründet sich auf meinen eigenen klinischen Erfahrungen in der operativen Behandlung alter Menschen. Dieser klinische Eindruck bestätigte sich auch in mehreren klinischen Studien zu Leberresektionen. Hierbei zeigten sich neben einem deutlich erhöhten Morbiditäts- und Mortalitätsrisiko zudem signifikant verlängerte Krankenhausverweildauern und damit verbunden sichtlich gestiegene Behandlungskosten.
Während aktuell in Deutschland ca. 12,7 Millionen Menschen älter als 65 Jahre und 4,1 Millionen Menschen älter als 80 Jahre sind, wächst diese Zahl laut Hochrechnungen des Statistischen Bundesamtes bis zum Jahre 2060 erwartungsgemäß auf 13 und 9 Millionen an. Damit steigt der Anteil älterer Menschen und damit auch älterer Patienten in unserer Gesellschaft von aktuell 20% auf 34% bis zum Jahr 2060. Neben dem humanistischen Gedanken eine optimale Versorgung für diese Patienten zu entwickeln, müssen hierbei auch gesundheitsökonomische Gesichtspunkte mit berücksichtigt werden. Unabdingbares Ziel sollte es sein, eine Entwicklung hin zu einer altersabhängigen Therapieentscheidung, wie sie sich in einigen Ländern bereits abzeichnet, abwenden zu können.
Derzeit werden ältere Patienten weder operativ technisch noch infrastrukturell in der Chirurgie anders versorgt als jüngere Patienten, hierin sehe ich ein strukturelles Problem. Da es jedoch zum aktuellen Zeitpunkt nur wenige Studien gibt, welche sich mit dem alternden Menschen in der Chirurgie beschäftigen und im Weiteren somit auch keine speziellen Handlungsempfehlungen oder Therapiepläne existieren, sehe ich hierin einen enormen Bedarf für unsere Patienten.
Mein Ziel ist es in einem translationalen Ansatz über eine Beeinflussung der Autophagie die Leberregeneration und damit das Outcome nach Leberresektionen im Alter zu verbessern. Die Autophagie, ein zentraler Survivalmechanismus der Zelle, ist entscheidend für die Leberregeneration. Mehrere aktuelle Arbeiten weisen auf eine Störung in diesem empfindlichen System im Alter hin, was zu einer verzögerten Regeneration führt. Mit meiner Arbeit möchte ich einen wesentlichen wissenschaftlichen Beitrag im Forschungsbereich „Autophagie der Leber“ eingebettet im Forschungskolleg AntiAge leisten.
Autophagie gehört zu den Mechanismen der molekularen und zellulären Qualitätskontrolle und ist für die Aufrechterhaltung der zellulären Homöostase verantwortlich. Daten der Arbeitsgruppe zeigen, dass vaskuläre Endothelzellen für ihre Funktionsfähigkeit hohe basale Autophagie-Raten benötigen und dass Autophagie in seneszenten humanen und in in-vivo gealterten Maus-Endothelzellen abnimmt. Das vorgelegte Projekt hat das Ziel, die Funktion der Autophagie in Endothelzellen weiter zu charakterisieren und einen kausalen Zusammenhang zwischen Abnahme der Autophagie und Altern der Zellen nachzuweisen. Dazu sollen die Auswirkung einer Autophagie-Hemmung beziehungsweise einer Autophagie-Aktivierung auf Parameter der Seneszenz sowie endotheliale Funktionen bestimmt werden. Die Mechanismen, die zur Inhibierung der Autophagie einschließlich der vermuteten Hemmung der Mitophagie führen, sollen aufgezeigt und ihre mögliche Reversibilität geprüft werden. Die Daten, die in kultivierten Zellen erhoben wurden, sollen in Mausmodellen überprüft werden. Wir erwarten neue Erkenntnisse zu Targeting-Strategien, mit deren Hilfe über eine Verhinderung der altersbedingten Autophagie-Hemmung endotheliale Funktionen erhalten und kardiovaskuläre Erkrankungen vermindert werden können.

Shaping excitatory responses of pyramidal neurons by the very diverse group of GABAergic interneurons is crucial for cortical information processing. Developmental defects that impair the establishment of such cortical circuits, have been implicated in a wide range of neurological disorders. Further, the selective vulnerability of inhibitory interneurons upon aging contributes to cognitive, sensory and motor performances of elderly.
Our research is focussed on the dynamics of epigenetic transcriptional control during neuronal development, function and age-associated neurodegeneration of the cerebral cortex. By dissecting interactive networks directing key events of these processes the pathophysiology of associated diseases can be better understood. Our work is based on the systemic and functional analysis of transgenic mouse models and diverse cell culture systems. For the cellular and sub-cellular analysis, we apply a battery of of biochemical, molecular and cell biological methods. These include primary neuronal cultures, functional in vitro assays, ex-vivo and in vivo genetic manipulations, methylation studies and life cell imaging. A recently established methodological focus relies on single cell and tissue-based global transcriptome analysis.
Webseite RWTH Aachen, Funktionale Epigenetik im Tiermodell
