Die funktionelle Vielfalt der SLC1-Transporterfamilie
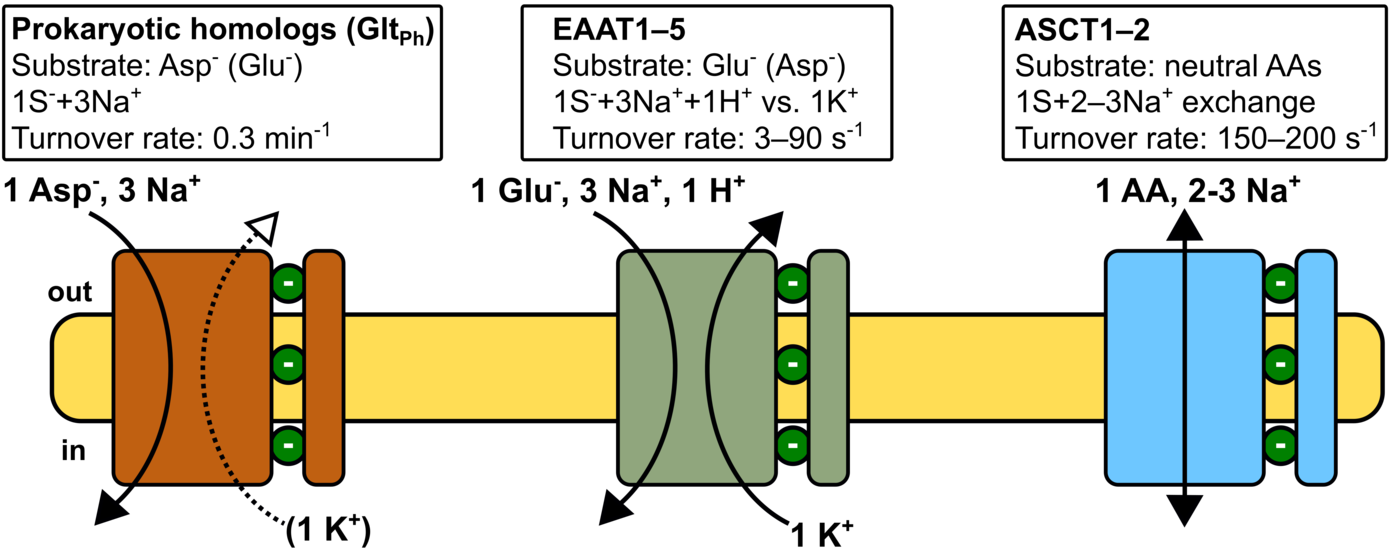
SLC1 Transporter vermitteln eine beeindruckende Vielfalt an Transportfunktionen, die von Na+/K+/H+-gekoppeltem, sekundär-aktivem Glutamat-Transport in EAATs, über Na+-gekoppelten Aspartat-Transport in prokaryotischen Homologen (z.B. GltPh oder GltTk) bis zum Austausch neutraler Aminosäuren durch ASCT-Transporter reicht. Wir werden mit einer Kombination aus atomistischen Molekulardynamik-Simulationen, Patch-Clamp-Elektrophysiologie und Fluoreszenz-Spektroskopie isoformspezifische Unterschiede in den Bindungsraten von Na+ und Aminosäuren sowie die Mechanismen der Ionen-Substrat-Kopplung untersuchen. SLC1-Proteine sind prototypische Elevator-Transporter, bei denen große Translations- und Rotationsbewegungen einer Transportdomäne dem Substrattransport über die Zellmembran zugrunde liegen. Kürzlich publizierte experimentelle Strukturen von GltPh und dem humanen ASCT2-Transporter definieren sowohl den Anfangs- als auch den Endzustand dieser Transportbewegung. Um die molekularen Grundlagen der Anpassung von Transportraten in den verschiedenen Isoformen aufzuklären, sollen die Energetik und Kinetik der Transmembran-Translokation und die Regulation dieses Prozesses durch Protein-Lipid-Interaktionen untersucht werden. Glutamat-Transporter sind vielversprechende, jedoch noch nicht etablierte, pharmakologische Zielstrukturen zur Behandlung der Glutamat-Exzitotoxizität, die in zahlreichen Erkrankungen des zentralen Nervensystems auftritt. Im Rahmen dieses Projekts sollen kürzlich identifizierte positive allosterische Modulatoren untersucht werden. Für diese Substanzen wurde eine Steigerung der EAAT-Transportaktivität und ein neuroprotektiver Effekt unter pathologischen Bedingungen nachgewiesen. Mit einer Kombination aus molekularen Simulationen, Kryoelektronenmikroskopie und Elektrophysiologie soll so der Wirkmechanismus dieser Substanzen aufgeklärt werden, um eine Grundlage für die weitere Entwicklung solcher EAAT-Aktivatoren zu legen.