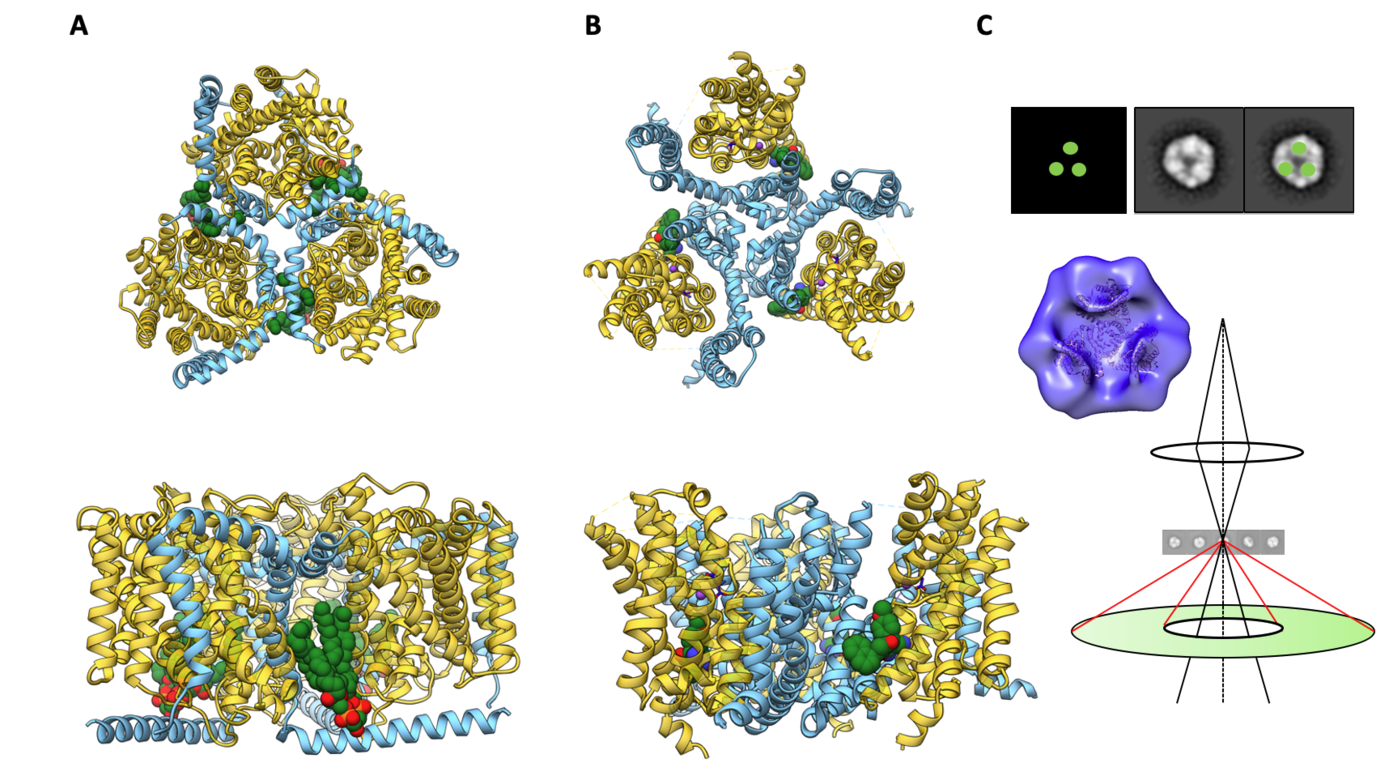
Einfluss der Membranlipide auf konformelle Änderungen während des Transportzyklus in trimeren Natrium-gekoppleten Symportern
Der Oligomerisierung Zustand von sekundären Transportern kann deren Funktion nachhaltig beeinflussen. Ein Paradebeispiel ist der Na+-gekoppelte Betaintransporter BetP, ein Mitglied der BCCT-Familie, der ausschließlich als Trimer reguliert wird. Im trimeren Zustand finden spezifische Lipidkontakte sowie intra-trimere Wechselwirkungen von terminalen Domänen statt, was zu einer Neuorientierung einzelner Protomere in Bezug auf die Membrannormale führt. Infolgedessen wird die Umsatzrate und Kooperativität der Na+-Kopplung in BetP in K+-abhängiger Weise verändert. Zu der Gruppe der trimeren Sekundärtransporter gehören auch die Na+/K+/H+-gekoppelten Glutamattransporter der SLC1-Familie, z.B. EAAT1. Diese besitzen eine zentrale "Trimerisierungsdomäne", die tief in die Membran eingebettet ist, und welche essentiell für die charakteristische Aufzugs-Bewegung der drei "Transportdomänen" während des Transportzyklus ist (Elevator-Mechanismus). Bei BetP ist die C-terminale Domäne der wesentliche Transport Regulator. Ebenso wurde in EAAT1 und EAAT2 gezeigt, dass die jeweiligen C-terminalen Domänen den Glutamataufnahmezyklus und die Chloridpermeabilität modifizieren.
In diesem Projekt wollen wir untersuchen, ob in trimerem EAAT1 und BetP ein gemeinsames mechanistisches Muster vorliegt, wie regulatorische und/oder modulierende Lipidwechselwirkungen die Kooperativität von Na+-Kopplung und K+-Antiport beeinflussen. Beide trimeren Symportern sind evolutionär nicht verwandt, daher würden mechanistische Ähnlichkeiten auf sehr allgemeine Prinzipien der Natrium-gekoppelten Transportregulation schließen lassen. Durch diese vergleichende Struktur-Funktions-Studie zur Rolle von Lipiden beim Transport in BetP und EAAT1 streben wir an: (1) die Rolle der Trimerisierung als Interaktionsplattform für Lipide und Modulatoren zu untersuchen und (2) die regulatorische Rolle von K+ bei der kooperativen Natriumkopplung in BetP und EAAT1 aufzuklären. Um dieses Ziel zu erreichen, wollen wir neue Techniken etablieren und diese mir cryo-EM Einzelteilchen Analyse kombinieren. Dabei handelt es sich um Kryo-Raster-Transmissionselektronenmikroskopie (Kryo-STEM) und optische Einzelmolekül-Raster-Nahfeldmikroskopie (s-SNOM) im FTIR-Modus. Mittels Kryo-STEM wollen wir K+ (Rb+)-Dichten in Kryo-EM-Strukturen identifizieren und die K+-Koordination in BetP und EAAT1 in nativer Lipidumgebung bestimmen. Um dynamische Lipidwechselwirkungen zu untersuchen, werden wir auf die innovative rastergestützte Spektroskopie Methode s-SNOM im FTIR-Modus zurückgreifen.